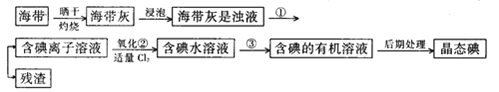
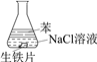题目内容
【题目】已知25℃时:①HF(aq)+OH-(aq)![]() F-(aq)+H2O(l) ΔH=-67.7 kJ/mol
F-(aq)+H2O(l) ΔH=-67.7 kJ/mol
②H+(aq)+OH-(aq)===H2O(l) ΔH=-57.3 kJ/mol下列有关说法中正确的是( )
A.HF电离:HF(aq)![]() H+(aq)+F-(aq)△H=+10.4KJ/mol
H+(aq)+F-(aq)△H=+10.4KJ/mol
B.水解消耗0.1 mol F-时,吸收的热量为6.77 kJ
C.中和热均为57.3 kJ/mol
D.含1 mol HF、1 mol NaOH的两种溶液混合后放出的热量为67.7 kJ
【答案】B
【解析】
A、利用盖斯定律将①②可得HF(aq)![]() F(aq)+H+(aq) ΔH=10.4kJmol1,故A错误;
F(aq)+H+(aq) ΔH=10.4kJmol1,故A错误;
B、依据反应的热化学方程式,HF(aq)+OH(aq)![]() F(aq)+H2O(1) ΔH=67.7kJ/mol,得到F(aq)+H2O(1)
F(aq)+H2O(1) ΔH=67.7kJ/mol,得到F(aq)+H2O(1)![]() HF(aq)+OH(aq) ΔH=+67.7kJ/mol,水解消耗0.1molF-时,吸收的热量为6.77kJ,故B正确;
HF(aq)+OH(aq) ΔH=+67.7kJ/mol,水解消耗0.1molF-时,吸收的热量为6.77kJ,故B正确;
C、中和热是强酸强碱的稀溶液全部反应生成1mol水放出的热量,弱酸弱碱或浓溶液反应,中和热不是57.3kJ/mol,故C错误;
D、HF是弱酸,电离过程依据A分析可知是放热,则含1molHF、1molNaOH的两种溶液混合后放出的热量大于67.7kJ,故D错误。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
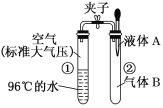
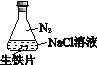
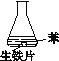
【题目】研究生铁的锈蚀,下列分析不正确的是
序号 | ① | ② | ③ |
实验 |
|
|
|
现象 | 8小时未观察 到明显锈蚀 | 8小时未观察 到明显锈蚀 | 1小时观察 到明显锈蚀 |
A. ①中,NaCl溶液中溶解的O2不足以使生铁片明显锈蚀
B. ②中,生铁片未明显锈蚀的原因之一是缺少H2O
C. ③中正极反应:O2+4e+ 2H2O ==4OH
D. 对比①②③,说明苯能隔绝O2