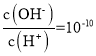题目内容
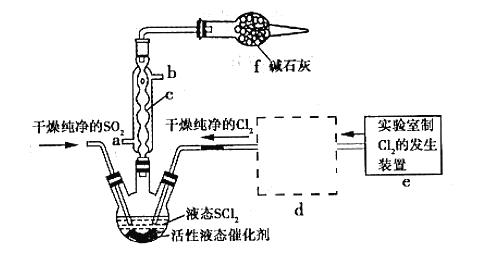
【题目】亚硫酰氯(俗称氯化亚砜,SOCl2)是一种液态化合物,沸点77℃,在农药、制药行业、有机合成等领域用途广泛。SOCl2遇水剧烈反应,液面上产生白雾,并常有刺激性气味的气体产生,实验室合成原理:SO2+Cl2+SCl2=2SOCl2,部分装置如图所示:
请回答下列问题:
(1)装置f的作用是____________
(2)实验室用二氧化锰与浓盐酸共热反应的离子方程式为____________。
(3)蒸干AlCl3溶液不能得到无水AlCl3,使SOCl2与AlCl3·6H2O混合加热,可得到无水AlCl3,试解释原因:_______________________________________________________
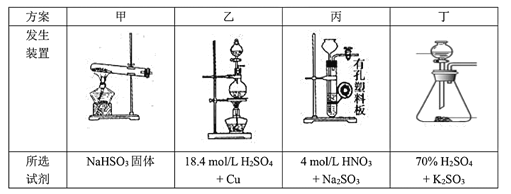
(4)下列四种制备SO2的方案中最佳选择是____。
(5)装置e中产生的Cl2经过装置d后进入三颈烧瓶, d中所用的试剂为_______。(按气流方向)
(6)实验结束后,将三颈烧瓶中混合物分离开的实验操作是________(己知SCl2的沸点为50℃)。若反应中消耗Cl2的体积为896 mL(己转化为标准状况,SO2足量),最后得到纯净的SOCl2 4.76 g,则SOCl2的产率为__________(保留三位有效数字)。
(7)分离产物后,向获得的SOCl2中加入足量NaOH溶液,振荡、静置得到无色溶液W,检验溶液W中存在Cl-的方法是_______________________________
【答案】吸收逸出有毒的Cl2、SO2,防止空气中的水蒸气进入反应装置,防止SOCl2水解 MnO2 + 4H++2Cl-![]() Mn2+ + Cl2↑ + 2H2O AlCl3·6H2O与SOCl2混合加热,SOCl2与AlCl3·6H2O中的结晶水作用,生成无水AlCl3及SO2和HCl气体, HCl抑制AlCl3水解 丁 饱和食盐水、浓硫酸 蒸馏 50.0% 取少量W溶液于试管中,加入过量 Ba(NO3)2溶液,静置,取上层清液,滴加 HNO3 酸化,再加入AgNO3溶液,产生白色沉淀,则说明溶液中有Clˉ
Mn2+ + Cl2↑ + 2H2O AlCl3·6H2O与SOCl2混合加热,SOCl2与AlCl3·6H2O中的结晶水作用,生成无水AlCl3及SO2和HCl气体, HCl抑制AlCl3水解 丁 饱和食盐水、浓硫酸 蒸馏 50.0% 取少量W溶液于试管中,加入过量 Ba(NO3)2溶液,静置,取上层清液,滴加 HNO3 酸化,再加入AgNO3溶液,产生白色沉淀,则说明溶液中有Clˉ
【解析】
(1)装置f的作用是吸收逸出有毒的Cl2、SO2,防止空气中的水蒸气进入反应装置,防止SOCl2水解;
(2)实验室用二氧化锰与浓盐酸共热反应生成氯化锰、氯气和水,反应的离子方程式为MnO2 + 4H++2Cl-![]() Mn2+ + Cl2↑ + 2H2O;
Mn2+ + Cl2↑ + 2H2O;
(3)AlCl3溶液易水解,AlCl36H2O与SOCl2混合加热,SOCl2与AlCl36H2O中的结晶水作用,生成无水AlCl3及SO2和HCl气体,SOCl2吸水,产物SO2和HCl溶于水呈酸性抑制水解发生;
(4)甲中加热亚硫酸氢钠确实会产生二氧化硫,但是同时也会生成较多的水蒸汽,故甲不选;
乙中18.4mol/L的浓硫酸与加热反应虽然能制取二氧化硫,但实验操作较复杂且消耗硫酸的量较多,硫酸的利用率低,故乙不选;
丙中无论是浓硝酸还是稀硝酸都具有很强的氧化性,可以轻易的将亚硫酸钠中的正4价的硫氧化为正6价的硫酸根离子而无法得到二氧化硫,故丙不选;
丁中反应生成硫酸钾与二氧化硫还有水,丁制取二氧化硫比较合理;
故答案为丁;
(5)装置e中产生的Cl2经过d后进入三颈烧瓶,d干燥氯气,且除去HCl,则d中所用的试剂分别为饱和食盐水、浓硫酸;
(6)已知氯化亚砜沸点为77℃,已知SCl2的沸点为50℃,所以采用分馏的方法即可将之分离;消耗氯气为![]() =0.04mol,由SO2+Cl2+SCl2═2SOCl2,生成0.08molSOCl2,则SOCl2的产率为
=0.04mol,由SO2+Cl2+SCl2═2SOCl2,生成0.08molSOCl2,则SOCl2的产率为![]() ×100%=50%;
×100%=50%;
(7)向获得的SOCl2中加入足量NaOH溶液,振荡、静止得到无色溶液w,含亚硫酸根离子和氯离子,检验溶液w中存在的Cl-的方法是取少量无色溶液放入试管中,加入Ba(NO3)2溶液至不再生沉淀为止,静置.取出上层清液,加入AgNO3溶液,有白色沉淀生成,可知无色溶液中含有Cl-。