题目内容
按要求回答下列问题。
(1)SO2是形成酸雨的罪魁祸首。 64 g SO2的物质的量为 ,在标准状况下的体积约为 ,所含原子数为 。
(2)写出除去下列物质所含杂质(括号内为杂质)所用的试剂或方法:
①Na2CO3固体(NaHCO3) ②FeCl3溶液(FeCl2)
③Mg粉(Al) ④CO2(SO2)
(1)1 mol , 22.4L , 3NA或1.806×1024
(2)①加热 ②Cl2 ③NaOH溶液(或KOH溶液) ④KMnO4(H+)溶液(或饱和NaHCO3溶液)
解析试题分析:(1)根据物质的理和质量,体积,微粒数的关系进行计算即可。(2)①Na2CO3固体(NaHCO3)由于后者能加热分解生成碳酸钠,故用加热法。②FeCl3溶液(FeCl2)Cl2能和氯化亚铁反应生成氯化铁。③Mg粉(Al)可加入强碱溶液进行过滤即可。④CO2(SO2)由于二氧化硫具有还原性或酸性较二氧化碳强,故可以选择KMnO4(H+)溶液(或饱和NaHCO3溶液)。
考点:本题考查物质的量与各量的间的转化计算及物质的除杂方法。

 阅读快车系列答案
阅读快车系列答案“84消毒液”能有效杀灭甲型H1N1病毒,某同学购买了一瓶某品牌“84消毒液”,并查阅相关资料和消毒液包装说明得到如下信息:
“84消毒液”:含25% NaClO、1 000 mL、密度1.19 g·cm-3,稀释100倍(体积比)后使用。
请根据以上信息和相关知识回答下列问题:
(1)该“84消毒液”的物质的量浓度为_____mol·L-1。
(2)该同学取100 mL该品牌“84消毒液”稀释后用于消毒,稀释后的溶液中
c(Na+)≈_____mol·L-1(假设稀释后溶液密度为1.0 g·cm-3)。
(3)该同学参阅该品牌“84消毒液”的配方,欲用NaClO固体配制480 mL含25% NaClO的消毒液。下列说法正确的是_____。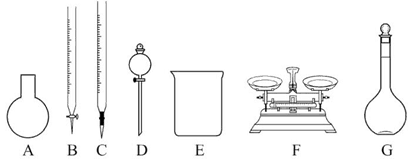
| A.如图所示的仪器中,有四种是不需要的,还需一种玻璃仪器 |
| B.容量瓶用蒸馏水洗净后,应烘干才能用于溶液配制 |
| C.利用购买的商品NaClO来配制可能导致结果偏低 |
| D.需要称量的NaClO固体质量为143 g |