题目内容
(1)相同物质的量的O2和O3,所含分子数目之比为_______,所含氧原子的物质的量之比为_________。
(2)在标准状况下,①4 g H2.②11.2 L O2.③1 mol H2O中,含原子数最多的是_ ___,体积最小的是_______。(填序号)
(3)标况下,将224L的HCl气体溶于835ml(ρ=1g/cm3)的水中,所得盐酸的密度为1.2g/cm3, 该盐酸的物质的量浓度___________.。
(4)某气体物质质量为6.4 g,含有6.02×1022个分子,则该气体的相对分子质量为_______。
(5)Na2CO3的摩尔质量是____________,0.5mol Na2CO3的质量是____________,含有________mol Na+,Na+的个数约为___________。
(1) 1:1 2:3 (2) ①, ③ (3) 10 mol?L?1
(4) 64 (5) 106g/mol, 53g,1mol, 6.02×1023。(每空1分,单位不写不给分)
解析试题分析:(1)O2和O3的物质的量相同,则O2和O3的分子数相等,所以分子数目之比为1:1;O2分子中含2个O原子,O3分子中含3个O原子,故所含氧原子的物质的量之比为2:3。
(2)4g H2为4g÷2g/mol=2mol,H原子为4mol,标准状况下11.2L O2为11.2L÷22.4L/mol=0.5mol,O原子为1mol,1mol H2O含3mol原子,所以原子数最多的①4 g H2;H2O在标准状况下不是气体,所以体积最小的是1 mol H2O。
(3)根据物质的量浓度定义式进行计算,c(HCl)="224L÷22.4L/mol÷[(224L÷22.4L/mol×36.5g/mol+" 835ml×1g/cm³)÷1200g/L]=10mol?L?1。
(4)6.02×1022个分子物质的量为:6.02×1022÷6.02×1023mol-1=0.1mol,摩尔质量为6.4g÷0.1mol=64g/mol,则该气体的相对分子质量为64。
(5)根据相对原子质量可求出Na2CO3的摩尔质量为106g/mol;则0.5mol Na2CO3的质量为:0.5mol×106g/mol=53g;含有1mol Na+;Na+的个数约为6.02×1023。
考点:本题考查有关物质的量的计算。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案某草酸盐晶体KxFey(C2O4)z?wH2O中铁为+3价,草酸根为-2价,且知x+y+z=7。取该晶体做了以下实验:
① 取4.910g晶体在不同温度下加热至恒重,所得固体的化学式和质量如下表:
| | 120℃ | 300℃ | 480℃ |
| 化学式 | KxFey(C2O4)z | KxFeyO(C2O4)z-1 | KxFeyO2(C2O4)z-2 |
| 质量 | 4.370g | 3.650g | 2.930 g |
② 另取4.910g晶体,经过加酸溶解、加足量碱沉淀、灼烧至恒重,铁元素全部转化为Fe2O3,质量为0.800g。
(1)计算得出草酸盐晶体中结晶水的质量分数为 (保留三位小数);
(2)R的化学式为 ;
(3)草酸盐晶体的摩尔质量为 ;
(4)试通过计算,确定草酸盐晶体的化学式。
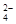 ,SO
,SO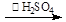
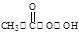 (过氧乙酸)+H2O
(过氧乙酸)+H2O