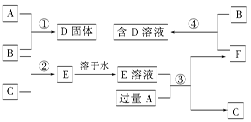题目内容
甲、乙、丙、丁四种物质(可以是溶液)中,甲、乙、丙均含有相同的某种元素,它们之间具有如下转化关系: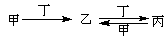 。按要求回答下列问题:
。按要求回答下列问题:
(1)若甲为碳,则乙为________(填化学式,下同),丙为_________。
(2)若甲为氯气,则丁为_______,丙为_________。
(3)若甲为二氧化硫,丁为氢氧化钠溶液,则丙→乙的离子方程式为_____________。
(4)若甲为氯化铝溶液,丁为氢氧化钠溶液,则乙→丙的离子方程式为_____________。
(1)CO;CO2 (2)Fe;FeCl2
(3)SO32-+SO2+H2O=2HSO3- (4)3AlO2-+Al3++6H2O=4Al(OH)3↓
解析试题分析:(1)由于甲、乙能连续与丁反应,且丙还能与价反应生成乙。则如果甲是碳,则符合转化关系的丁应该是氧气,乙是CO,丙是CO2。
(2)若甲为氯气,则丁应该是变价的金属,所以丁是铁,乙是氯化铁。在溶液中氯化铁能和铁反应生成氯化亚铁,即丙是氯化亚铁。氯化亚铁被氯气氧化又转化为氯化铁。
(3)若甲为二氧化硫,丁为氢氧化钠溶液,则乙应该是亚硫酸氢钠,丙是亚硫酸钠,所以丙→乙的离子方程式为SO32-+SO2+H2O=2HSO3-。
(4)若甲为氯化铝溶液,丁为氢氧化钠溶液,则乙应该是氢氧化铝。丙是偏铝酸钠,则乙→丙的离子方程式为Al(OH)3 + OH-=AlO2-+2H2O
考点:考查无机框图题转化的有关判断

练习册系列答案
相关题目
Ⅰ.下列化合物中,含有非极性共价键的离子化合物是 ( )。
| A.CaC2 | B.N2H4 | C.Na2S2 | D.NH4NO3 |
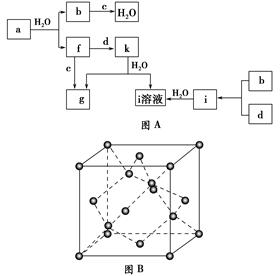
回答下列问题:
(1)图B对应的物质名称是________,其晶胞中的原子数为________,晶体类型为________。
(2)d中元素的原子核外电子排布式为________。
(3)图A中由二种元素组成的物质中,沸点最高的是________,原因是________________________________________________________________________,该物质的分子构型为________,中心原子的杂化轨道类型为________。
(4)图A中的双原子分子中,极性最大的分子是________。
(5)k的分子式为________,中心原子的杂化轨道类型为________,属于________分子(填“极性”或“非极性”)。