题目内容
8.W、X、Y、Z四种短周期元素在周期表中的位置如图所示,W的气态氢化物可与其最高价氧化物对应水化物反应生成离子化合物,由此可知( )| W | X | |
| Y | Z |
| A. | Z元素的氧化物对应水化物的酸性一定强于Y | |
| B. | X、Y、Z中最简单氢化物稳定性最弱的是Y | |
| C. | X元素的简单离子还原性大于Y | |
| D. | Z元素单质在化学反应中只表现氧化性 |
分析 由短周期元素W、X、Y、Z在元素周期表中的位置,可知W、X处于第二周期,Y、Z处于第三周期,W的气态氢化物可与其最高价氧化物对应水化物反应生成离子化合物,则W为N元素,可推知X为O元素、Y为S元素、Z为Cl,据此解答.
解答 解:由短周期元素W、X、Y、Z在元素周期表中的位置,可知W、X处于第二周期,Y、Z处于第三周期,W的气态氢化物可与其最高价氧化物对应水化物反应生成离子化合物,则W为N元素,可推知X为O元素、Y为S元素、Z为Cl.
A.次氯酸为弱酸,而硫酸为强酸,应是最高价含氧酸Z>Y,故A错误;
B.非金属性X>Y、Z>Y,故最简单氢化物稳定性最弱的是Y,故B正确;
C.非金属性X>Y,阴离子的还原性:X<Y,故C错误;
D.氯气与氢氧化钠反应生成氯化钠、次氯酸钠与水,反应中氯气表现氧化性、还原性,故D错误,
故选:B.
点评 本题考查结构性质位置关系应用,难度不大,推断元素是解题关键,A选项为易错点,学生容易忽略最高价含氧酸,注意对基础知识的理解掌握.

练习册系列答案
 永乾教育寒假作业快乐假期延边人民出版社系列答案
永乾教育寒假作业快乐假期延边人民出版社系列答案
相关题目
19.下列化学式及结构式中,从成键情况看不合理的是( )
| A. | CH4Si: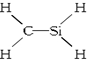 | B. | CH4S: | C. | CH2SeO: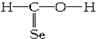 | D. | CH3N: |
3.医学研究证明,用放射性${\;}_{53}^{136}$I治疗肿瘤可收到一定疗效,下列有关${\;}_{53}^{136}$I叙述正确的是( )
| A. | ${\;}_{53}^{136}$I是碘的一种同素异形体 | |
| B. | ${\;}_{53}^{136}$I位于元素周期表中第四周期ⅦA族 | |
| C. | ${\;}_{53}^{136}$I是一种新发现的元素 | |
| D. | ${\;}_{53}^{136}$I核内的中子数与核外电子数之差为29 |
13.有关甲、乙两种非金属的下列说法中,能说明甲比乙的非金属性强的是( )
①甲与氢气化合比乙容易
②甲的最高价氧化物对应水化物酸性比乙的强
③甲的单质能与乙的阴离子发生置换反应
④甲的氢化物比乙的稳定
⑤甲的氢化物还原性比乙的强
⑥与金属反应甲得电子比乙多.
①甲与氢气化合比乙容易
②甲的最高价氧化物对应水化物酸性比乙的强
③甲的单质能与乙的阴离子发生置换反应
④甲的氢化物比乙的稳定
⑤甲的氢化物还原性比乙的强
⑥与金属反应甲得电子比乙多.
| A. | ①②③ | B. | ①②③④ | C. | ①②③④⑤ | D. | ①②③④⑤⑥ |
20.关于下列图示装置的描述中,不正确的是( )
| A. | 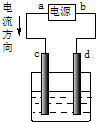 c为阳极,d为阴极 | |
| B. | 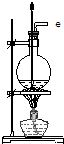 用于实验室蒸馏石油 | |
| C. | 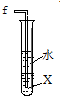 X为CCl4时,可用于吸收氯化氢气体,并防止倒吸 | |
| D. | 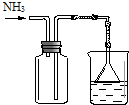 用于收集氨气及并进行尾气吸收 |
17.实验室用图所示的装置制取乙酸乙酯,下列说法正确的是( )
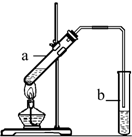

| A. | 向a试管中先加入浓硫酸,然后边摇动试管边慢慢加入乙醇,再加冰醋酸 | |
| B. | 用CH3CH218OH与乙酸反应制取乙酸乙酯,18O 存在于水中 | |
| C. | 试管b中的液体是饱和NaHCO3溶液 | |
| D. | 实验时加热试管a的目的之一是及时将乙酸乙酯蒸出,使平衡向生成乙酸乙酯的方向移动 |
18.X、Y、Z、R是中学化学常见的4种主族元素,原子序数依次增大.Y在周期表前20号元素中原子半径最大;X、Y可以形成YX型离子化合物,且离子核外电子数相等;Z、R可以形成共价分子RZ,两原子最外层均达到8电子结构,R显+1价.回答下列问题:
(1)Y的单质与水反应的化学方程式是2K+2H2O=2KOH+H2↑.
(2)R元素在周期表中位于第戊周期ⅦA族.
(3)根据原子结构理论预测:按X、Z、R顺序,原子核外电子层数依次递增,原子半径逐渐增大,得电子能力逐渐减弱,非金属性逐渐减弱,所以X、Z、R三种元素的非金属性由强及弱的顺序是Cl>Br>I(填写元素符号).
(4)为了证明这一结论,甲同学设计了如下实验:
乙同学分析后认为:用甲同学的实验设计比较R、Z的非金属性不够严谨,你认为他的理由可能是实验I结束后Cl2可能剩余.
丙同学为了比较R、Z的非金属性,在甲同学方案的基础上补充设计了如下实验:
向Y、Z、R简单离子的混合溶液中,加入少许CCl4,滴加少量X单质的水溶液,振荡,观察CCl4层的颜色.
丙同学的设计依据是在含有I-、Br-离子溶液中加入少量Cl2,还原性强的物质先被氧化.
(1)Y的单质与水反应的化学方程式是2K+2H2O=2KOH+H2↑.
(2)R元素在周期表中位于第戊周期ⅦA族.
(3)根据原子结构理论预测:按X、Z、R顺序,原子核外电子层数依次递增,原子半径逐渐增大,得电子能力逐渐减弱,非金属性逐渐减弱,所以X、Z、R三种元素的非金属性由强及弱的顺序是Cl>Br>I(填写元素符号).
(4)为了证明这一结论,甲同学设计了如下实验:
| 序号 | 实验内容 | 实验现象 | 用离子方程式解释现象 |
| 实验Ⅰ | 向YZ的水溶液中,加入少许CCl4,逐滴滴加X单质的水溶液,振荡. | CCl4层颜色变成橙红色 | 发生反应的离子方程式是Cl2+2Br-=2Cl-+Br2. |
| 实验Ⅱ | 向上述溶液中加入少量YR的水溶液,振荡. | CCl4层颜色变成紫红色 | 发生反应的离子方程式是Br2+2I-=2Br-+I 2. |
丙同学为了比较R、Z的非金属性,在甲同学方案的基础上补充设计了如下实验:
向Y、Z、R简单离子的混合溶液中,加入少许CCl4,滴加少量X单质的水溶液,振荡,观察CCl4层的颜色.
丙同学的设计依据是在含有I-、Br-离子溶液中加入少量Cl2,还原性强的物质先被氧化.
 某浅绿色晶体X[x(NH4)2SO4•yFeSO4•zH2O]在分析化学上常用作还原剂.为确定其组成,某小组同学进行如下实验.
某浅绿色晶体X[x(NH4)2SO4•yFeSO4•zH2O]在分析化学上常用作还原剂.为确定其组成,某小组同学进行如下实验. →
→ .
.