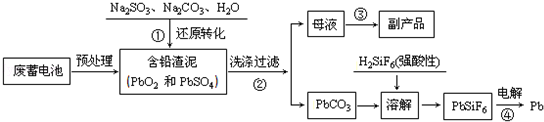
题目内容
13.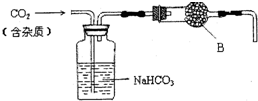 实验室中的CO2气体用大理石和稀盐酸反应制取,并用如图装置进行提纯和干燥.
实验室中的CO2气体用大理石和稀盐酸反应制取,并用如图装置进行提纯和干燥.(1)用浓盐酸配制1:1(体积比)的稀盐酸(约6mol•L-1)时,通常选用的仪器是abc.
a.烧杯 b.玻璃棒 c.量筒 d.容量瓶
(2)上述装置中,NaHCO3溶液可以吸收吸收HCl气体或吸收酸性气体.
(3)B中试剂可能是b(填“a”、“b”或“c”)
a.碱石灰 b.无水CaCl2 c.浓硫酸.
分析 (1)配制一定体积比的溶液时,应选用烧杯、玻璃棒和量筒;
(2)碳酸氢钠溶液用于吸收HCl气体或吸收酸性气体;
(3)CO2气体可用中性和酸性物质干燥,干燥管内盛固体.
解答 解:(1)配制一定体积比的溶液时,应选用烧杯、玻璃棒和量筒,用量筒量出相同体积的浓盐酸和水,倒入烧杯中,用玻璃棒搅拌加速溶解,故答案为:abc;
(2)碳酸氢钠溶液用于吸收HCl气体或吸收酸性气体,故答案为:吸收HCl气体或吸收酸性气体;
(3)CO2气体可用中性和酸性物质干燥,干燥管内盛固体,故应为氯化钙,故答案为:b.
点评 本题考查了溶液的配制、气体的除杂、实验设计和评价等知识,题目难度中等,该题很好的将化学实验与其他化学知识有机地结合于一体,综合考查学生的能力和素质,考查知识也是从简单到复杂、从单一到综合,是一道质量结合的题目.

练习册系列答案
 全优测试卷系列答案
全优测试卷系列答案 冲刺100分1号卷系列答案
冲刺100分1号卷系列答案
相关题目
3.为了得到比较纯净的物质,使用的方法恰当的是( )
| A. | 向Na2CO3饱和溶液中,通入过量的CO2后,在减压、加热的条件下,蒸发得NaHCO3晶体 | |
| B. | 加热蒸发AlCl3饱和溶液得纯净的AlCl3晶体 | |
| C. | 向FeBr2溶液中加入过量的氯水,加热蒸发得FeCl3晶体 | |
| D. | 向FeCl3溶液里加入足量NaOH溶液,经过滤、洗涤沉淀,再充分灼烧沉淀得Fe2O3 |
8.核反应堆通常使用235 U和239 Pu作为原料,研究和开发核能可以减少对化石燃料的依赖.下列说法正确的是( )
| A. | 235U比239 Pu原子核内少4个中子 | |
| B. | 核反应堆中使用的重水与水互为同位素 | |
| C. | 石油、天然气等化石燃料属于可再生能源 | |
| D. | 合理使用核能可有效减少温室气体的排放 |
18.A、B、C、D、E是原子序数依次增大的短周期元素,A可以与氢组成气态氢化物分子中氢元素的质量百分含量为最高的物质,C是地壳中含量最高的金属,D与C可以形成C2D3型的化合物.
(1)C的离子结构示意图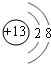 E在周期表中的位置第三周期第VIIA族
E在周期表中的位置第三周期第VIIA族
(2)A与氢元素组成的化合物分子甲中含有8个原子,与D同主族的某元素与氢组成的化合物乙与甲的电子数相等,则乙的电子式为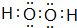
(3)B的最简单气态氢化物丙的水溶液显碱性
①在微电子工业中丙的水溶液与乙反应的产物不污染环境,其相互反应的化学方程式为2NH3•H2O+3H2O2=N2↑+8H2O
②一定条件下,丙在固定体积的密闭容器中分解(△H>0)并到达平衡,仅改变下列条件X平衡体系中随X递增Y递减的是ab
(4)C2D3能否通过复分解反应制取不能原因Al3+、S2-在水溶液中发生强烈双水解生成Al(OH)3与H2S
(5)A与D形成的液态化合物AD20.2mol在O2中完全燃烧,生成两种稳定的气态氧化物,在298K时放出热量215kJ写出表示该化合物燃烧热的热化学方程式:CS2(l)+3O2(g)=CO2(g)+2SO2(g)△H=-1075kJ/mol.
(1)C的离子结构示意图
 E在周期表中的位置第三周期第VIIA族
E在周期表中的位置第三周期第VIIA族(2)A与氢元素组成的化合物分子甲中含有8个原子,与D同主族的某元素与氢组成的化合物乙与甲的电子数相等,则乙的电子式为
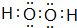
(3)B的最简单气态氢化物丙的水溶液显碱性
①在微电子工业中丙的水溶液与乙反应的产物不污染环境,其相互反应的化学方程式为2NH3•H2O+3H2O2=N2↑+8H2O
②一定条件下,丙在固定体积的密闭容器中分解(△H>0)并到达平衡,仅改变下列条件X平衡体系中随X递增Y递减的是ab
| 选项 | a | b | c | d |
| X | 温度 | 加入氢气 | 加入丙 | 温度 |
| Y | n(丙) | 丙的转化率 | n(生成物) | n(H2) |
(5)A与D形成的液态化合物AD20.2mol在O2中完全燃烧,生成两种稳定的气态氧化物,在298K时放出热量215kJ写出表示该化合物燃烧热的热化学方程式:CS2(l)+3O2(g)=CO2(g)+2SO2(g)△H=-1075kJ/mol.
2.称取一定质量的纯碱溶于水中,与适量的盐酸作用,下列关于盐酸的用量和气体产量的变化正确的是( )
| A. | 若纯碱中混有K2CO3,盐酸用量将偏大;气体产量将偏大 | |
| B. | 若纯碱中混有NaHCO3,盐酸用量将偏大;气体产量将偏大 | |
| C. | 若纯碱中混有KHCO3,盐酸用量将偏小;气体产量将偏大 | |
| D. | 若纯碱中混有Na2SO3,盐酸用量将偏大;气体产量将偏小 |
3.下列反应的离子方程式正确的是( )
| A. | 铁片与氯化铜溶液反应:Fe+Cu2+═Cu+Fe3+ | |
| B. | 氯化钡溶液与稀硫酸反应:Ba2++SO42-═BaSO4↓ | |
| C. | 碳酸钠溶液与盐酸反应:Na2CO3+2H+═2Na++CO2↑+H2O | |
| D. | NaHCO3溶液中加入过量Ba(OH)2溶液:HCO3-+Ba2++OH-═BaCO3↓+H2O |
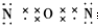 ,其空间构型是直线形,由此可知它是非极性(填“极性”或“非极性”)分子.
,其空间构型是直线形,由此可知它是非极性(填“极性”或“非极性”)分子.