题目内容
3.下列反应的离子方程式正确的是( )| A. | 铁片与氯化铜溶液反应:Fe+Cu2+═Cu+Fe3+ | |
| B. | 氯化钡溶液与稀硫酸反应:Ba2++SO42-═BaSO4↓ | |
| C. | 碳酸钠溶液与盐酸反应:Na2CO3+2H+═2Na++CO2↑+H2O | |
| D. | NaHCO3溶液中加入过量Ba(OH)2溶液:HCO3-+Ba2++OH-═BaCO3↓+H2O |
分析 A.应生成Fe2+;
B.氯化钡溶液与稀硫酸反应生成硫酸钡沉淀;
C.Na2CO3为强电解质,应写成离子;
D.NaHCO3溶液中加入过量Ba(OH)2溶液反应生成碳酸钡和水.
解答 解:A.不符合反应的实际,应为Fe+Cu2+═Cu+Fe2+,故A错误;
B.氯化钡溶液与稀硫酸反应生成硫酸钡沉淀,反应的离子方程式为Ba2++SO42-═BaSO4↓,故B正确;
C.Na2CO3为强电解质,应写成离子,离子方程式为CO32-+2H+═CO2↑+H2O,故C错误;
D.NaHCO3溶液中加入过量Ba(OH)2溶液反应生成碳酸钡和水,反应的离子方程式为HCO3-+Ba2++OH-═BaCO3↓+H2O,故D正确.
故选BD.
点评 本题考查离子反应方程式的书写,为高频考点,把握发生的化学反应及离子反应的书写方法为解答的关键,侧重复分解反应的考查,题目难度中等.

练习册系列答案
相关题目
8.下列离子方程式错误的是( )
| A. | 向Ba(OH)2溶液中滴加稀硫酸:Ba2++2OH-+2H++SO42-═BaS04↓+2H2O | |
| B. | 酸性介质中KMnO4氧化 H2O2:2MnO4-+5H2O2+6H+═2Mn2++5O2↑+8H2O | |
| C. | 等物质的量的MgCl2、Ba(OH)2 和 HCl 溶液混合:Mg2++2OH-═Mg(OH)2↓ | |
| D. | 铅酸蓄电池充电时的正极反应:PbSO4+2H2O-2e-═PbO2+4H++SO42- |
15.恒容下的2SO2+O2 ?2SO3;△H<0,达到平衡后,下列可以加快反应速率的方法是( )
| A. | 将SO3分离出一部分 | B. | 升温 | ||
| C. | 充入少量N2,增大压强 | D. | 充入少量SO3气体 |
13.只用胶头滴管和试管通过两试剂的互滴,不能区别的下列溶液(浓度均为0.1mol/L)( )
| A. | NaAlO2和稀盐酸 | B. | NaHCO3和Ca(OH)2 | C. | NaOH和Al2(SO4)3 | D. | HCl和Na2CO3 |
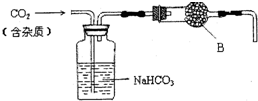 实验室中的CO2气体用大理石和稀盐酸反应制取,并用如图装置进行提纯和干燥.
实验室中的CO2气体用大理石和稀盐酸反应制取,并用如图装置进行提纯和干燥.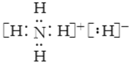 ,该物质能与水剧烈反应生成两种气体,这两种气体的化学式是H2、NH3.
,该物质能与水剧烈反应生成两种气体,这两种气体的化学式是H2、NH3. H2CO3+OH-.该盐溶液与足量稀硫酸混合,当生成11.2L(标准状况)气体(不考虑气体溶解)时放热6.32kJ,写出该反应的热化学方程式:HCO3-(aq)+H+(aq)=H2O(l)+CO2(g)△H=-12.64kJ•mol-1.
H2CO3+OH-.该盐溶液与足量稀硫酸混合,当生成11.2L(标准状况)气体(不考虑气体溶解)时放热6.32kJ,写出该反应的热化学方程式:HCO3-(aq)+H+(aq)=H2O(l)+CO2(g)△H=-12.64kJ•mol-1. 如图所示物质的转化关系中,A是一种固体单质,E是一种白色沉淀.请回答下列问题:
如图所示物质的转化关系中,A是一种固体单质,E是一种白色沉淀.请回答下列问题:
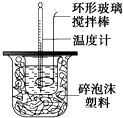 在量热器中将50ml、0.50mol•L-1CH3COOH溶液与50ml、0.55mol•L-1NaOH溶液混合,温度从25.160C升高到27.460C.已知量热计的热容常数(量热计各部件每升高10C所需的热量)是150J•0C-1,C=4.18J•g-1•0C-1,溶液的密度为1g•cm-3.
在量热器中将50ml、0.50mol•L-1CH3COOH溶液与50ml、0.55mol•L-1NaOH溶液混合,温度从25.160C升高到27.460C.已知量热计的热容常数(量热计各部件每升高10C所需的热量)是150J•0C-1,C=4.18J•g-1•0C-1,溶液的密度为1g•cm-3.