题目内容
8.核反应堆通常使用235 U和239 Pu作为原料,研究和开发核能可以减少对化石燃料的依赖.下列说法正确的是( )| A. | 235U比239 Pu原子核内少4个中子 | |
| B. | 核反应堆中使用的重水与水互为同位素 | |
| C. | 石油、天然气等化石燃料属于可再生能源 | |
| D. | 合理使用核能可有效减少温室气体的排放 |
分析 A.根据粒子间的数量关系进行计算;
B.有相同质子数,不同中子数的原子或同一元素的不同核素互为同位素;
C.化石燃料属于不可再生能源;
D.核反应无二氧化碳排放.
解答 解:A.U:中子数=质量数-质子数=235-92=143,Pu:中子数=质量数-质子数=239-94=145,145-143=2,故A错误;
B.重水与水都是化合物,故B错误;
C.石油、天然气等化石燃料属于不可再生能源,故C错误;
D.核反应无二氧化碳排放,故D正确,
故选D.
点评 本题考查粒子间的数量关系、同位素的概念、可再生能源的判断、温室气体的排放灯,知识点较多,难度不大.要注意平时知识的积累.

练习册系列答案
相关题目
19.下表是元素周期表的一部分,针对表中的①~⑨种元素,用化学用语填空:
(1)元素②的原子结构示意图为 ,元素②原子核内含有6个中子的原子可表示为137N.
,元素②原子核内含有6个中子的原子可表示为137N.
(2)在最高价氧化物的水化物中,酸性最强的化合物的化学式是HClO4.
(3)元素①与⑥形成的化合物的电子式为: .
.
(4)⑤、⑥、⑨三种元素形成的简单离子,离子半径由大到小的顺序是S2->K+>Mg2+.
(5)实验室用元素③的氢化物制取③的单质的反应为2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑.
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | VA | ⅥA | ⅤⅡA | 0族 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ |
 ,元素②原子核内含有6个中子的原子可表示为137N.
,元素②原子核内含有6个中子的原子可表示为137N.(2)在最高价氧化物的水化物中,酸性最强的化合物的化学式是HClO4.
(3)元素①与⑥形成的化合物的电子式为:
 .
.(4)⑤、⑥、⑨三种元素形成的简单离子,离子半径由大到小的顺序是S2->K+>Mg2+.
(5)实验室用元素③的氢化物制取③的单质的反应为2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑.
16.设NA为阿佛加德罗常数的值,下列叙述中不正确的是( )
| A. | 46gNO2气体中含有原子数为3NA | |
| B. | 标准状况下22.4LH2中含质子数为2NA | |
| C. | 13gZn与足量盐酸反应可放出氢气4.48L | |
| D. | 标准状况下,11.2LN2和 CO的混和气体物质的量为0.5mol |
3.实验室用FeCl2和烧碱制备Fe(OH)2,为了生成的产物不容易被氧化,下列说法不正确的是( )
| A. | 配制FeCl2和烧碱溶液所用的蒸馏水通常要煮沸 | |
| B. | 可在FeCl2溶液的上面加一层苯,以隔绝空气 | |
| C. | 向FeCl2溶液中滴加烧碱溶液时,胶头滴管尖嘴不能伸入到试管内 | |
| D. | 产生Fe(OH)2沉淀后,不能震荡试管 |
20.有A、B、C、D四种强电解质,它们在水中电离可以产生下列离子(每种物质只含一种阴离子且互不重复)
已知:A、C溶液的PH均大于7,相同温度、浓度的A、B溶液中水的电离程度相同.
C溶液与D溶液混合只产生沉淀,B溶液与C溶液混合只产生刺激性气味的气体,A溶液与D溶液混合时无明显现象.则
(1)A为CH3COONaB为NH4Cl(写化学式)
(2)若常温下浓度为Cmol/L的A溶液中水电离出的C(H+)=10-5mol/L,则此溶液的PH=9.在此条件下,若将浓度均为2cmol/L的A与B溶液等体积混合后,所得溶液中由水电离的C(H+)>10-5mol/L( 填“>”“<”或“=”)此溶液的PH近似等于7.
(3)25C0时0.1mol/LB溶液的PH=a,则B溶液中 C(H+)-C(NH3.H2O)=10 a-14mol/L(用a表示)
(4)25C0时,在一定体积的0.005mol/L的C溶液中.加入一定体积的0.00125mol/L的盐酸混合后PH=11,若不考虑溶液体积变化,则C溶液与盐酸溶液的体积比为1:4.
| 阳离子 | Na+、Ba2+、NH4+ |
| 阴离子 | CH3COO-、Cl-、OH-、SO42- |
C溶液与D溶液混合只产生沉淀,B溶液与C溶液混合只产生刺激性气味的气体,A溶液与D溶液混合时无明显现象.则
(1)A为CH3COONaB为NH4Cl(写化学式)
(2)若常温下浓度为Cmol/L的A溶液中水电离出的C(H+)=10-5mol/L,则此溶液的PH=9.在此条件下,若将浓度均为2cmol/L的A与B溶液等体积混合后,所得溶液中由水电离的C(H+)>10-5mol/L( 填“>”“<”或“=”)此溶液的PH近似等于7.
(3)25C0时0.1mol/LB溶液的PH=a,则B溶液中 C(H+)-C(NH3.H2O)=10 a-14mol/L(用a表示)
(4)25C0时,在一定体积的0.005mol/L的C溶液中.加入一定体积的0.00125mol/L的盐酸混合后PH=11,若不考虑溶液体积变化,则C溶液与盐酸溶液的体积比为1:4.
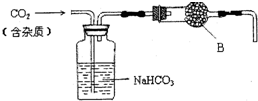 实验室中的CO2气体用大理石和稀盐酸反应制取,并用如图装置进行提纯和干燥.
实验室中的CO2气体用大理石和稀盐酸反应制取,并用如图装置进行提纯和干燥.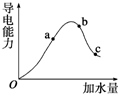 一定温度下,冰醋酸加水稀释过程中溶液的导电能力有如图所示曲线,请回答.
一定温度下,冰醋酸加水稀释过程中溶液的导电能力有如图所示曲线,请回答.