题目内容
下列叙述正确的是( )
| A、0.01mol/L CH3COOH与pH=12的NaOH溶液混合,若有c(CH3COO-)>c(Na+),则混合液一定呈碱性 |
| B、0.1mol/L NaHCO3溶液中c(OH-)=c(H+)+c(CO32-)+2c(H2CO3) |
| C、0.1mol/L的某二元弱酸盐Na2A溶液中,c(Na+)=2c(H2A)+2c(HA-)+2c(A2-) |
| D、100mL 1.0 mol?L-1 Fe(NO3)2溶液和100mL 2.0 mol?L-1 HNO3溶液混合后:c(NO3-)=2.0mol?L-1 |
考点:酸碱混合时的定性判断及有关ph的计算,盐类水解的应用,离子浓度大小的比较
专题:电离平衡与溶液的pH专题,盐类的水解专题
分析:A.c(CH3COO-)>c(Na+),根据电荷守恒c(Na+)+c(H+)=c(CH3COO-)+c(OH-)可知,c(H+)>c(OH-);
B.根据碳酸氢钠溶液中电荷守恒、物料守恒判断各离子浓度之间关系;
C.根据二元弱酸盐Na2A溶液中的物料守恒进行判断;
D.硝酸与亚铁离子发生氧化还原反应,导致硝酸根离子的物质的量减小.
B.根据碳酸氢钠溶液中电荷守恒、物料守恒判断各离子浓度之间关系;
C.根据二元弱酸盐Na2A溶液中的物料守恒进行判断;
D.硝酸与亚铁离子发生氧化还原反应,导致硝酸根离子的物质的量减小.
解答:
解:A.0.01mol/L CH3COOH与pH=12的NaOH溶液混合,若c(CH3COO-)>c(Na+),溶液中一定满足电荷守恒:c(Na+)+c(H+)=c(CH3COO-)+c(OH-),则c(H+)>c(OH-),溶液一定显示酸性,故A错误;
B.碳酸氢钠中电荷守恒为:①c(Na+)+c(H+)=c(HCO3-)+2c(CO32-)+c(OH-),物料守恒为:②c(Na+)=c(HCO3-)+c(CO32-)+c(H2CO3),将②带人①可得:c(OH-)+c(CO32-)=c(H+)+c(H2CO3),故B错误;
C.该二元弱酸盐Na2A溶液中有多满足物料守恒:c(Na+)=2c(H2A)+2c(HA-)+2c(A2-),故C正确;
D.100mL 1.0 mol?L-1 Fe(NO3)2溶液和100mL 2.0 mol?L-1 HNO3溶液混合后,如果不发生反应,则混合后溶液中硝酸根离子浓度为2mol/L,由于硝酸具有强氧化性,能够氧化亚铁离子,导致反应后溶液中硝酸根离子小于2mol/L,故D错误;
故选C.
B.碳酸氢钠中电荷守恒为:①c(Na+)+c(H+)=c(HCO3-)+2c(CO32-)+c(OH-),物料守恒为:②c(Na+)=c(HCO3-)+c(CO32-)+c(H2CO3),将②带人①可得:c(OH-)+c(CO32-)=c(H+)+c(H2CO3),故B错误;
C.该二元弱酸盐Na2A溶液中有多满足物料守恒:c(Na+)=2c(H2A)+2c(HA-)+2c(A2-),故C正确;
D.100mL 1.0 mol?L-1 Fe(NO3)2溶液和100mL 2.0 mol?L-1 HNO3溶液混合后,如果不发生反应,则混合后溶液中硝酸根离子浓度为2mol/L,由于硝酸具有强氧化性,能够氧化亚铁离子,导致反应后溶液中硝酸根离子小于2mol/L,故D错误;
故选C.
点评:本题考查了酸碱混合的定性判断、溶液中离子浓度大小比较,题目难度中等,注意掌握盐的水解原理及其应用方法,能够根据电荷守恒、物料守恒、盐的水解原理判断溶液中各离子浓度大小,选项D为易错点,注意部分硝酸根离子被还原成一氧化氮气体.

练习册系列答案
相关题目
盆烯的分子结构如图所示(其中碳、氢原子均已略去).关于盆烯的说法正确的是( )
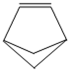

| A、盆烯的一氯取代物有4种 |
| B、盆烯是乙烯的一种同系物 |
| C、盆烯是苯的一种同分异构体 |
| D、盆烯为不饱和烃,能与氢气发生加成反应 |
含硒(Se)的保健品已开始进入市场.已知硒与氧、硫同主族,与溴同周期,则下列关于硒的叙述中,正确的是( )
| A、非金属性比硫强 |
| B、氢化物比HBr稳定 |
| C、处于金属与非金属的分界线上 |
| D、最高价氧化物的水化物为H2SeO4 |
下列关于苯的同系物的命名说法中错误的是( )
| A、苯的同系物命名必须以苯作为母体,其他的基团作为取代基 |
| B、二甲苯可以以邻、间、对这种习惯方法进行命名 |
| C、二甲苯也可以用系统方法进行命名 |
| D、化学式是C8H10的苯的同系物有4种同分异构体 |
0.02mol氯化铬(CrCl3?6H2O)在水溶液中用过量的AgNO3处理,产生0.04mol AgCl沉淀,此氯化铬最可能形成的是( )
| A、[Cr(H2O)6]Cl3 |
| B、[Cr(H2O)3Cl3]?3H2O |
| C、[Cr(H2O)4Cl2]Cl?2H2O |
| D、[Cr(H2O)5Cl]Cl2?H2O |
下列反应过程中,同时有离子键、极性键和非极性键的断裂和形成的是( )
A、NH4HCO3
| ||||
| B、NH3+HCl═NH4Cl | ||||
C、2Na+O2
| ||||
| D、2Na2O2+2H2O═4NaOH+O2↑ |
要得到较大颗粒的明矾晶体,在结晶时可如下操作( )
| A、配制比室温高10~20℃明矾饱和溶液然后浸入悬挂的明矾小晶核,静置过夜 |
| B、在沸水中配制明矾饱和溶液,然后急速冷却结晶 |
| C、室温下,在明矾饱和溶液中投入明矾小晶核,静置过夜 |
| D、进行快速蒸发明矾饱和溶液至大量晶体析出 |
下列说法正确的是( )
| A、凡是中心原子采取sp3杂化的分子,其立体构形都是正四面体 |
| B、CH4分子中的sp3杂化轨道是由4个H原子的1s轨道和C原子的2p轨道混合起来而形成的 |
| C、杂化轨道只用于形成σ键或用于容纳未参与成键的孤电子对 |
| D、凡AB3型的共价化合物,其中心原子A均采用sp3杂化轨道成键 |
下列烃在光照下与氯气反应,只生成一种一氯代物的有( )
| A、2-甲基丁烷 |
| B、2,2-二甲基丙烷 |
| C、2,2-二甲基丁烷 |
| D、2-甲基丙烷 |