题目内容
3.实验室配制500mL 0.5mol•L-1的NaCl溶液,有如下操作步骤:①把称量好的NaCl晶体放入小烧杯中,加适量蒸馏水溶解;
②把①所得溶液小心转入500mL容量瓶中;
③继续向容量瓶中加蒸馏水至液面距离刻度l~2cm处,改用胶头滴管小心滴加适量的蒸馏水后停止滴加;
④用少量蒸馏水洗涤烧杯和玻璃棒2~3次,每次洗涤的液体都小心转入容量瓶,并轻轻摇匀;
⑤将容量瓶塞紧,充分摇匀.
请填写下列空白:
(1)实验操作步骤的正确顺序为(填序号)①②④③⑤.
(2)实验中用托盘天平称取NaCl晶体的质量是14.6g.
(3)上述操作步骤③中定容时,如果加水超过了刻度线,应如何处理?需重新配制溶液.
(4)若实验时出现如下情况,对所配溶液浓度将有何影响?(选填“偏高”、“偏低”、“无影响”)
①定容时,俯视刻度线:偏高.
②移液后,未洗涤烧杯和玻璃棒:偏低.
分析 (1)根据配制一定物质的量浓度的溶液方法骤排序;
(2)根据m=nM=cVM及天平的读数情况计算氯化钠的质量;
(3)如果加水超过了刻度线,需要重新配制;
(4)根据c=$\frac{n}{V}$分析操作对溶质的物质的量或对溶液的体积的影响判断.
解答 解:(1)配制一定物质的量浓度的溶液的步骤有:计算、称量、溶解、冷却、移液、洗涤、定容、摇匀等操作,所以正确的操作顺序为:①②④③⑤,
故答案为:①②④③⑤;
(2)需要氯化钠的质量为:m=nM=cVM=0.5mol•L-1×0.5L×58.5g/mol=14.625g,天平的最小读数为0.1g,则需要称量的NaCl的质量为:14.6g,
故答案为:14.6g;
(3)定容时,如果加水超过了刻度线,溶液的体积偏大,导致配制溶液的浓度偏低,此次配制失败,需要重新配制,
故答案为:需重新配制溶液;
(4)①定容时,俯视刻度线,导致溶液的体积偏小,所以配制溶液的浓度偏高,
故答案为:偏高;
②移液后,未洗涤烧杯和玻璃棒,导致溶质的物质的量偏小.所以配制溶液的浓度偏低,
故答案为:偏低.
点评 本题考查了一定物质的量浓度溶液的配制,题目难度不大,注意掌握配制一定物质的量浓度的溶液方法,易错题是(4)题,误差的分析是学习的难点,会根据c=$\frac{n}{V}$分析操作对溶质的物质的量或对溶液的体积的影响来判断配制溶液的浓度是偏高还是偏低.

练习册系列答案
相关题目
14.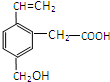 某有机物的结构如图所示,这种有机物不可能具有的性质是
某有机物的结构如图所示,这种有机物不可能具有的性质是
①能使酸性KMnO4溶液褪色;②可以燃烧;
③能发生水解反应;④能发生酯化反应;
⑤能发生加聚反应;⑥能跟NaOH溶液反应( )
 某有机物的结构如图所示,这种有机物不可能具有的性质是
某有机物的结构如图所示,这种有机物不可能具有的性质是①能使酸性KMnO4溶液褪色;②可以燃烧;
③能发生水解反应;④能发生酯化反应;
⑤能发生加聚反应;⑥能跟NaOH溶液反应( )
| A. | ①④ | B. | 只有⑥ | C. | 只有③ | D. | ④⑥ |
11.体积相同、pH相同的HCl溶液和CH3COOH溶液,与NaOH溶液中和,两者消耗NaOH的物质的量( )
| A. | 相同 | B. | 中和HCl的多 | C. | 中和CH3COOH的多 | D. | 无法比较 |
8.某气态烃1mol能与2molHCl加成,加成后产物分子上的氢原子又可被6molCl2取代,则该气态烃可能是( )
| A. | CH2=CH2 | B. | CH≡C-CH3 | C. | CH2=CH2 | D. | CH2=CH-CH=CH2 |
15.设NA为阿伏伽德罗常数的值,则下列叙述正确的是( )
| A. | 1mol Na2O2固体中含有的阴离子数为2NA | |
| B. | 常温常压下,3.2g CH4中含有的电子数为2NA | |
| C. | 标准状况下,11.2L乙酸乙酯中含有的分子数为0.5NA | |
| D. | 100mL 1mol•L-1 CH3COOH溶液中含有的CH3COOH分子数为0.1NA |
12.在一定温度下,10mL0.40mol/LH2O2溶液发生催化分解,不同时刻测得生成O2的体积(已这算为标准状况)如下表.下列叙述不正确的是(溶液体积变化忽略不计)( )


| A. | 0-6min的平均反应速率:v(H2O2)≈3.3×10-2mol/(L•min) | |
| B. | 6-10min的平均反应速率:v(H2O2)<3.3×10-2mol/(L•min) | |
| C. | 反应到6min时,H2O2分解了50% | |
| D. | 反应到6min时,c(H2O2)=0.30mol/L |
20.设NA为阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 3.6g重水中含有的中子数为2NA | |
| B. | 16.0g的过氧(根)离子中含有的电子数为9NA | |
| C. | 100mL 3.0mol/L的盐酸与5.6g铁屑完全反应转移的电子数为0.3NA | |
| D. | 含2mol H2SO4的浓硫酸与足量金属铜完全反应,产生SO2分子数为NA |
 (1)18电子分子中含有4个原子,其结构式是H-O-O-H或PH3
(1)18电子分子中含有4个原子,其结构式是H-O-O-H或PH3