题目内容
【题目】Ⅰ.甲同学用含少量铁的氧化物的氧化铜制取氯化铜晶体(CuCl2·xH2O)并测量其结晶水含量。已知:在pH为4~5时,Fe3+几乎完全水解而沉淀,而此时Cu2+却几乎不水解。制取流程如下:

请回答下列问题:
(1)溶液A中的金属离子有Fe3+、Fe2+、Cu2+。能检验溶液A中Fe2+的试剂为________(填编号)。
①KMnO4 ②K3[Fe(CN)6] ③NaOH ④KSCN
(2)试剂①是________,试剂②是________。(填化学式)
(3)为了测定制得的氯化铜晶体(CuCl2·xH2O)中x的值,某兴趣小组设计了以下实验方案:
称取m g晶体溶于水,加入足量氢氧化钠溶液、过滤、沉淀洗涤后用小火加热至质量不再减轻为止,冷却,称量所得黑色固体的质量为n g。沉淀洗涤的操作方法是________,根据实验数据测得x=________(用含m、n的代数式表示)。
Ⅱ.乙同学设计了一套电解饱和食盐水的实验装置,来验证氯气的某些性质和测定产生的氢气的体积。
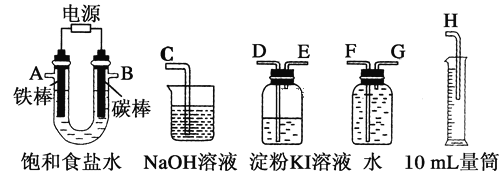
(4)所选仪器接口的连接顺序是A接________,________接________;B接________,________接________。
(5)若装入的饱和食盐水为75 mL(氯化钠足量,电解前后溶液体积变化可忽略,假设两极产生的气体全部逸出),当测得氢气为8.4 mL(已转换成标准状况下的体积)时停止通电。将U形管内的溶液倒入烧杯,常温时测得溶液的pH约为________。
【答案】①② H2O2(或Cl2等合理答案) CuO[或Cu2(OH)2CO3等合理答案] 向过滤器中加入适量的蒸馏水使其刚好浸没沉淀,待水流下后,再次加入蒸馏水,重复2~3次 (80m-135n)/18n GFHDEC 12
【解析】
Ⅰ.根据Fe2+和Fe3+的特点分析作答;
(2)根据题意,试剂①应为氧化剂,目的是把Fe2+氧化成Fe3+,且不能引入新杂质原则加入试剂;
(3)根据洗涤沉淀的规范模板描述答题;根据铜元素守恒,进行计算;
Ⅱ.(4)根据实验目的知,铁棒只能作阴极,碳棒作阳极,根据产生气体的性质或收集方式连接仪器;
(5)由 知,通过氢气的量根据方程式计算溶液中氢氧根离子的浓度,再计算氢离子浓度及pH。
知,通过氢气的量根据方程式计算溶液中氢氧根离子的浓度,再计算氢离子浓度及pH。
Ⅰ.(1)①Fe2+具有还原性,其能与高锰酸钾溶液反应而使高锰酸钾溶液褪色,①符合题意;
②Fe2+与K3[(CN)6]溶液反应生成蓝色沉淀,②符合题意;
③Fe2+、Fe3+、Cu2+都可以与OH-结合生成沉淀,且不易观察沉淀颜色,③不符合题意;
④Fe2+不能使KSCN溶液发生颜色变化,而Fe3+可使KSCN溶液变为红色,④不符合题意,
故答案为:①②;
(2)根据题意,试剂①应为氧化剂,目的是把Fe2+氧化成Fe3+,且不能引入新杂质,所以试剂①可以为H2O2或Cl2;为得到较纯的产品,需要调节pH使Fe3+转化为沉淀,则试剂②可以是CuO[或Cu2(OH)2CO3等合理答案],故答案为:H2O2(或Cl2等合理答案);CuO[或Cu2(OH)2CO3等合理答案];
(3)沉淀洗涤的操作方法向过滤器中加入适量的蒸馏水使其刚好浸没沉淀,待水流下后,再次加入蒸馏水,重复2~3次;根据铜元素守恒,有
CuCl2→Cu(OH)2→CuO
1 1
m/(135+18x) n/80
即m/(135+18x)=n/80,解得x=(80m-135n)/18n;
Ⅱ.(4)根据实验目的知,铁棒只能作阴极,产生H2,碳棒作阳极,产生Cl2;产生的氢气的体积用排水量气法测定,排水时导管应短进长出,所以A接G,F接H;用装有淀粉KI溶液的洗气瓶检验氯气时,导管应长进短出,氯气有毒,要进行尾气处理,所以B接D,E接C;淀粉KI溶液变蓝的原因是Cl2+2I-=I2+2Cl-,故答案为:G;F;H;D;E;C;
(5)由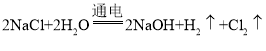 知,当产生的H2的体积为8.4mL,即3.75×10-4mol时,生成NaOH的物质的量为7.5×10-4mol,所以溶液中c(OH-)=c(NaOH)=
知,当产生的H2的体积为8.4mL,即3.75×10-4mol时,生成NaOH的物质的量为7.5×10-4mol,所以溶液中c(OH-)=c(NaOH)=![]() =0.01mol/L,所以c(H+)=
=0.01mol/L,所以c(H+)=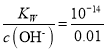 mol/L =10-12 mol/L,则pH=12。
mol/L =10-12 mol/L,则pH=12。

【题目】向1L含0.01molNaAlO2和0.02molNaOH的溶液中缓慢通入二氧化碳,随n(CO2)增大,先后发生三个不同的反应,当0.01mol<n(CO2) ![]() 0.015时发生的反应是:2 NaAlO2+ CO2+2H2O=2Al(OH)3↓+Na2CO3下列对应关系正确的是( )
0.015时发生的反应是:2 NaAlO2+ CO2+2H2O=2Al(OH)3↓+Na2CO3下列对应关系正确的是( )
选项 | n(CO2)/mol | 溶液中离子的物质的量浓度 |
A | 0 | c(Na+)>c(AlO2-)+c(OH-) |
B | 0.01 | c(Na+)>c(AlO2-)> c(OH-)>c(CO32-) |
C | 0.015 | c(Na+)> c(HCO3-)>c(CO32-)> c(OH-) |
D | 0.03 | c(Na+)> c(HCO3-)> c(OH-)>c(H+) |
A. A B. B C. C D. D
【题目】类推思维是化学解题中常用的一种思维方法,下列有关反应方程式的类推正确的是
已知 | 类推 | |
A | 将Fe加入CuSO 4 溶液中 Fe+Cu 2+ =Cu+Fe 2+ | 将Na加入到CuSO 4 溶液中 2Na+Cu 2+ =Cu+2Na + |
B | 铁和氯气反应2Fe+3Cl 2 | 镁和氯气反应Mg + Cl 2 |
C | 稀硫酸与NaOH溶液反应至中性 H + +OH - =H 2 O | 稀硫酸与Ba(OH)2溶液反应至中性 H + +OH - =H 2 O |
D | 向AlCl 3溶液中加入过量NaOH溶液 Al3+ +4OH- = AlO2- +2H2O | 向AlCl 3溶液中加入过量氨水 Al3+ +4OH- = AlO2- +2H2O |
A. A B. B C. C D. D