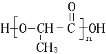题目内容
【题目】X、Y、Z、W是四种短周期主族元素,X原子最外层上的电子数是原子核外电子层数的2倍;Y 原子最外层电子数是次外层电子数的2倍;Z元素的单质为双原子分子;Z的氢化物能与其最高价氧化物的水化物形成盐;W元素最高正价是+7价。回答下列问题:
(1)元素X原子结构示意图为________________,其周期表中的位置为__________。
(2)元素Y的一种同位素可测定文物年代,这种同位素的符号是______________。
(3)元素W的单质与元素X的低价氧化物在水溶液中反应的离子方程式为__________。
(4)ZW3可与水反应生成一种酸和一种碱,反应的化学方程式为__________。
【答案】 第三周期第ⅥA族 146C Cl2+SO2+2H2O═4H++2Cl-+SO42- NCl3+4H2O═3HClO+NH3H2O
第三周期第ⅥA族 146C Cl2+SO2+2H2O═4H++2Cl-+SO42- NCl3+4H2O═3HClO+NH3H2O
【解析】
X原子最外层上的电子数是原子核外电子层数的2倍,X可能为碳元素或硫元素;Y原子最外层电子数是次外层电子数的2倍,说明Y只有2个电子层,且最外层有4个电子,Y为碳元素;Z的氢化物能与其最高价氧化物的水化物形成盐,因此Z为氮元素;W的最高正价为+7,而F元素无正价,因此W为氯元素,综上得X、Y、Z、W分别为S、C、N、Cl。
(1)X为硫元素,原子结构示意图为: ,电子层数等于周期数,最外层电子数等于主族序数,则硫元素位于第三周期第ⅥA族;
,电子层数等于周期数,最外层电子数等于主族序数,则硫元素位于第三周期第ⅥA族;
(2)碳的放射性同位素146C可用于考古;
(3)Cl2与SO2在水溶液中反应离子方程式为:Cl2+SO2+2H2O═4H++2Cl-+SO42-;
(4)NCl3与H2O反应生成物中有碱,只能是NH3H2O,N为-3价,Cl为+1价,酸应为HClO,反应方程式为:NCl3+4H2O═3HClO+NH3H2O。

 浙大优学小学年级衔接捷径浙江大学出版社系列答案
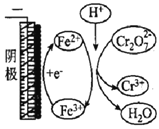
浙大优学小学年级衔接捷径浙江大学出版社系列答案【题目】用电解法处理含Cr2O72-的废水,探究不同因素对含Cr2O72-废水处理的影响,结果如表所示(Cr2O72-的起始浓度、体积、电压、电解时间均相同)。下列说法错误的是
实验 | i | ii | iii | iv |
|
是否加入Fe2(SO4)3 | 否 | 否 | 加入30g | 否 | |
是否加入H2SO4 | 否 | 加入1mL | 加入1mL | 加入1mL | |
阴极村料 | 石墨 | 石墨 | 石墨 | 石墨 | |
阳极材料 | 石墨 | 石墨 | 石墨 | 铁 | |
Cr2O72-的去除率 | 0.092% | 12.7% | 20.8% | 57.3% | 实验iii中Fe3+去除Cr2O72-的机理 |
A. 实验ⅱ与实验i对比,其他条件不变,增加c(H+)有利于Cr2O72-的去除
B. 实验ⅲ与实验ⅱ对比,其他条件不变,增加c(Fe3+)有利于Cr2O72-的去除
C. 实验ⅳ中Fe2+循环利用提高了Cr2O72-的去除率
D. 若实验ⅳ中去除0.01 mol Cr2O72-,生成的阳离子全部转化成沉淀,则沉淀的质量是2.06g