题目内容
【题目】短周期主族元素X、Y、Z、W原子序数依次增大,X原子核外有9个电子,Y原子最外层电子数是最内层电子数的一半,Z最高正价是最低负价绝对值的3倍。下列叙述正确的是( )
A. 原子半径:W<X<Y<Z
B. 化合物Y2Z中既有离子键、又有共价键
C. Y、W最高价氧化物对应水化物的溶液均能溶解氧化铝
D. 简单气态氢化物的稳定性由强到弱的顺序:Z、W、X
【答案】C
【解析】
在短周期主族元素中,核外电子数是9的元素是F,所以X是F,最外层电子数是最内层一半的元素是Na,所以Y是Na,最高正价是最低负价绝对值的3倍的元素是S,所以Z是S,则W就是Cl。
经分析可知:X是F,Y 是Na,Z是S,W是Cl;
A.原子半径由小到大的顺序是:X![]() W
W ![]() Z
Z![]() Y,故A错误;
Y,故A错误;
B.化合物Y2Z是Na2S,在Na2S中,只有离子键没有共价键,故B错误;
C.Y、W最高价氧化物对应水化物分别是:NaOH、HClO4,分别为强碱和强酸,氧化铝为两性氧化物,所以水溶液均能溶解氧化铝,故C正确;
D.简单气态氢化物的稳定性由强到弱的顺序是:HF![]() HCl
HCl ![]() H2S ,故D错误;
H2S ,故D错误;
本题答案为C。

【题目】硼镁泥是一种工业废料,主要成份是MgO(占40%,质量分数),还有CaO、MnO、Fe2O3、FeO、Al2O3、SiO2等杂质,以此为原料制取的硫酸镁,可用于印染、造纸、医药等工业。从硼镁泥中提取MgSO47H2O的工艺流程如下:
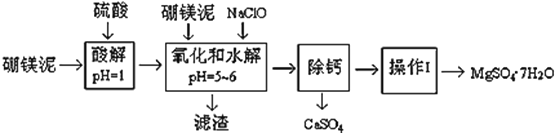
(1)实验中需要1 mol/L的硫酸800 mL,若用 98% 的浓硫酸(ρ= 1.84 g/mL)来配制,量取浓硫酸需要使用量筒的规格为__________(填写选项字母)
A.10 mL B.20 mL C.50 mL D.100 mL
(2)加入的NaClO可与Mn2+ 反应:Mn2+ + ClO + H2O = MnO2↓+ 2H+ + Cl ,在该步骤中还有一种离子也会被NaClO氧化,该反应的离子方程式为___________________。
(3)滤渣的主要成分除含有Fe(OH)3、Al(OH)3外,还含有__________,___________。
(4)在“除钙”前,需检验滤液中Fe3+ 是否被除尽,简述检验方法___________________。(写出操作、现象和结论)
(5)已知MgSO4、CaSO4 的溶解度(单位为 g/100 g 水)如下表:
温度(℃) | 40 | 50 | 60 | 70 |
MgSO4 | 30.9 | 33.4 | 35.6 | 36.9 |
CaSO4 | 0.210 | 0.207 | 0.201 | 0.193 |
“除钙”是将MgSO4和CaSO4混合溶液中的CaSO4除去,根据上表数据,简要说明操作步骤______。“操作Ⅰ”是将滤液继续蒸发浓缩,冷却结晶,______,便得到了MgSO47H2O
(6)实验中提供的硼镁泥共100 g,得到 MgSO47H2O为172.2 g ,则MgSO47H2O 的产率为___。
【题目】下表为原子序数依次增大的短周期元素A~F的第一到第五电离能数据,表中的金属元素是
电离能I(ev) | A | B | C | D | E | F |
I1 | 5.2 | 7.6 | 6.0 | 11.3 | 13.6 | 14.5 |
I2 | 49.3 | 15.0 | 18.8 | 24.4 | 35.1 | 29.6 |
I3 | 71.6 | 80.1 | 28.4 | 47.9 | 54.9 | 47.4 |
I4 | 98.9 | 109.2 | 112.0 | 64.5 | 77.4 | 77.5 |
I5 | 138.3 | 141.3 | 153.7 | 392.1 | 113.9 | 97.9 |
A.A B CB.B C DC.C D ED.D E F



