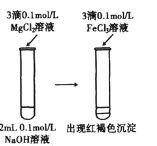
题目内容
【题目】CS(NH2)2(硫脲,白色而有光泽的晶体,溶于水,20℃时溶解度为13.6g;在150 ℃时转变成NH4SCN)是用于制造药物、染料、金属矿物的浮选剂等的原料。某化学实验小组同学用Ca(HS)2与CaCN2(石灰氮)合成硫脲并探究其性质。
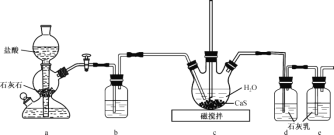
(1)制备Ca(HS)2溶液,所用装置如图(已知酸性:H2CO3>H2S):
①装置a中反应发生的操作为 _________;装置b中盛放的试剂是________ 。
②装置c中的长直导管的作用是________。
(2)制备硫脲:将CaCN2与Ca(HS)2溶液混合,加热至80℃时,可合成硫脲,同时生成一种常见的碱,合适的加热方式是__________;该反应的化学方程式为____________________。
(3)探究硫脲的性质:①取少量硫脲溶于水并加热,验证有NH4SCN生成,可用的试剂是_____(填化学式,下同)
②向盛有少量硫脲的试管中加入NaOH溶液,有NH3放出,检验该气体的方法为 ______。
③可用酸性KMnO4溶液滴定硫脲,已知MnO![]() 被还原为Mn2+,CS(NH2)2被反应为CO2、N2及SO
被还原为Mn2+,CS(NH2)2被反应为CO2、N2及SO![]() ,该反应中氧化剂与还原剂的物质的量之比为_____。
,该反应中氧化剂与还原剂的物质的量之比为_____。
【答案】打开装置a、b 之间的活塞 饱和NaHCO3溶液 作安全导管,避免烧瓶内压强过大 水浴加热 2CaCN2+ Ca(HS)2+ 6H2O![]() 2CS(NH2)2+ 3Ca(OH)2 FeCl3 用湿润的红色石蕊试纸置于试管口,若变蓝则为NH3 14:5
2CS(NH2)2+ 3Ca(OH)2 FeCl3 用湿润的红色石蕊试纸置于试管口,若变蓝则为NH3 14:5
【解析】
(1)装置b中的试剂用于除去CO2中混有的HCl,应加入饱和NaHCO3溶液;
(3)检验SCN-用Fe3+;检验NH3用湿润的红色石蕊试纸;用酸性KMnO4溶液滴定硫脲,反应的离子方程式为:![]() ,可得氧化剂与还原剂的物质的量之比。
,可得氧化剂与还原剂的物质的量之比。
(1)①装置a中,需防止启普发生器内正压力的形成,所以应打开活塞,装置b中的试剂应能除去CO2中混有的HCl,同时又不能吸收CO2,应加入饱和NaHCO3溶液;故答案为:打开装置a、b 之间的活塞;饱和 NaHCO3 溶液;
②当装置c中压力过大时,可通过调节c中的液体量来调节压强,所以长直导管的作用是:作安全导管,避免烧瓶内压强过大;故答案为:作安全导管,避免烧瓶内压强过大;
(2)将CaCN2与Ca(HS)2溶液混合,加热至80℃时,可合成硫脲,同时生成Ca(OH)2,因为温度不高于100℃且需控制,所以合适的加热方式是水浴加热;该反应的化学方程式为:2CaCN2 + Ca(HS)2+ 6H2O![]() 2CS(NH2)2 + 3Ca(OH)2;故答案为:水浴加热;2CaCN2 + Ca(HS)2+ 6H2O
2CS(NH2)2 + 3Ca(OH)2;故答案为:水浴加热;2CaCN2 + Ca(HS)2+ 6H2O![]() 2CS(NH2)2 + 3Ca(OH)2;
2CS(NH2)2 + 3Ca(OH)2;
(3)①验证有NH4SCN生成,既可验证![]() ,又可验证SCN-,但验证SCN-的效果更好,可选用FeCl3;故答案为:FeCl3;
,又可验证SCN-,但验证SCN-的效果更好,可选用FeCl3;故答案为:FeCl3;
②检验NH3的方法是将湿润的红色石蕊试纸置于试管口,若试纸变蓝则为NH3;故答案为:用湿润的红色石蕊试纸置于试管口,若变蓝则为NH3;
③已知![]() 被还原为Mn2+,则发生反应的离子方程式为:
被还原为Mn2+,则发生反应的离子方程式为:![]() ,该反应中氧化剂为
,该反应中氧化剂为![]() ,还原剂为CS(NH2)2,二者的物质的量之比为14:5,故答案为:14:5。
,还原剂为CS(NH2)2,二者的物质的量之比为14:5,故答案为:14:5。