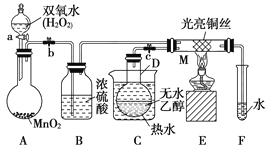
题目内容
【题目】在25°C时,向a mL 0.10mol·L-1的HNO2溶液中逐滴加入0.10mol·L-1的NaOH溶液,滴定过程中,混合溶液的pOH[pOH= -lgc(OH-)]与NaOH溶液的体积V的关系如图所示。已知P点溶液中存在c(OH-)=c(H+)+c(HNO2),下列说法不正确的是( )
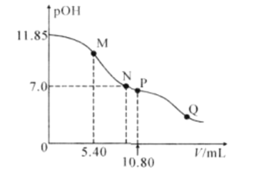
A.25°C时,HNO2电离常数的数量级是10-4
B.M点溶液中存在:3c(H+)+ c(HNO2)=3c(OH-)+ c(NO2-)
C.图上M、N、P、Q四点溶液中所含离子的种类相同
D.a=10.80
【答案】B
【解析】
已知P点溶液中存在c(OH-)=c(H+)+c(HNO2),同时溶液中存在电荷守恒:c(OH-)+c(NO2-)=c(H+)+c(Na+),二式联立可得:c(NO2-)+c(HNO2)=c(Na+),此为NaNO2溶液中的物料守恒式,即P点溶液中的溶质只有NaNO2,亚硝酸和氢氧化钠恰好完全反应,所以初始亚硝酸溶液的体积为10.80mL,据此分析作答。
A. HNO2的电离常数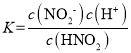 ,未滴加氢氧化钠时,0.1mol/L的HNO2溶液的pOH=11.85,即溶液中c(OH-)=10-11.85mol/L,根据水的离子积可知c(H+)=10-2.15mol/L,溶液中存在电离平衡HNO2H++NO2-,溶液中氢离子浓度和亚硝酸根离子浓度大致相等,所以
,未滴加氢氧化钠时,0.1mol/L的HNO2溶液的pOH=11.85,即溶液中c(OH-)=10-11.85mol/L,根据水的离子积可知c(H+)=10-2.15mol/L,溶液中存在电离平衡HNO2H++NO2-,溶液中氢离子浓度和亚硝酸根离子浓度大致相等,所以![]() ,故25°C时,HNO2电离常数的数量级是10-4,故A正确;
,故25°C时,HNO2电离常数的数量级是10-4,故A正确;
B. 根据以上分析可知a=10.80,所以当加入5.40mL氢氧化钠溶液时溶液中的溶质为等物质的量的HNO2和NaNO2,存在电荷守恒:c(OH-)+c(NO2-)=c(H+)+c(Na+),存在物料守恒:c(NO2-)+c(HNO2)=2c(Na+),二式联立可得2c(H+)+c(HNO2)=2c(OH-)+c(NO2-),故B错误;
C. M、N、P、Q四点溶液中均含有:H+、OH-、NO2-、Na+,故四点溶液中所含离子的种类相同,故C正确;
D. 根据以上分析可知a=10.80,故D正确;
故选B。