题目内容
常见的五种盐A、B、C、D、E,它们的阳离子可能是Na+、NH4+、Cu2+、Ba2+、Al3+、Ag+、Fe3+,阴离子可能是Cl-、NO3-、SO42-、CO32-,已知:
①五种盐均溶于水,水溶液均为无色。
②D的焰色反应呈黄色。
③A的溶液呈中性,B、C、E的溶液呈酸性,D的溶液呈碱性。
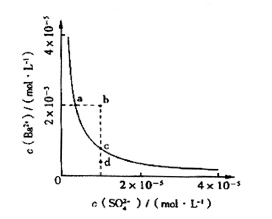
④若在这五种盐的溶液中分别加入Ba(NO3)2溶液,只有A、C的溶液不产生沉淀。
⑤若在这五种盐的溶液中,分别加入氨水,E和C的溶液中生成沉淀,继续加氨水,C中沉淀消失。
⑥把A的溶液分别加入到B、C、E的溶液中,均能生成不溶于稀硝酸的沉淀。
请回答下列问题:
(1)五种盐中,一定没有的阳离子是____________;所含阴离子相同的两种盐的化学式是 。
(2)D的化学式为_________,D溶液显碱性的原因是(用离子方程式表示):
。
(3)E和氨水反应的离子方程式是___________________________________ _____。
(4)设计实验检验B中所含的阳离子:
。
⑴Cu2+、Fe3+ ;(NH4)2SO4、Al2(SO4)3
⑵Na2CO3 CO32-+H2O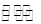 HCO3-+OH-
HCO3-+OH-
⑶Al3++NH3·H2O=Al(OH)3↓+3NH4+
⑷取少量B于试管中,滴加少量氢氧化钠溶液,在试管中附近放一张湿润的红色石蕊试纸,给试管加热,若试纸变蓝,说明B中含有NH4+。
解析试题分析:①五种盐均溶于水,水溶液均为无色。表明不含有Cu2+(蓝色)、Fe3+ (棕黄色);②D的焰色反应呈黄色,表明D中含有Na元素。③A的溶液呈中性,B、C、E的溶液呈酸性,D的溶液呈碱性。表明D一定为Na2CO3。⑤若在这五种盐的溶液中,分别加入氨水,E和C的溶液中生成沉淀,继续加氨水,C中沉淀消失。表明C中一定含有Ag+,结合前面的信息,可知C一定为AgNO3。⑥把A的溶液分别加入到B、C、E的溶液中,均能生成不溶于稀硝酸的沉淀。结合前面的信息,可知A为BaCl2,B为(NH4)2SO4。E为Al2(SO4)3。
考点:考查无机化合物的有关知识。

向一定量的Fe、FeO、Fe2O3的混合物中加入120mL4mol/L的稀硝酸,恰好使混合物完全溶解,放出1.344LNO(标准状况),往所得溶液中加入KSCN溶液,无红色出现。若用足量的氢气在加热下还原相同质量的混合物,能得到铁的物质的量为
| A.0.24 mol | B.0.21 mol | C.0.16 mol | D.0.14 mol |
 4CO(g)+BaS(s)△H1=+571.2kJ?mol-1 ①
4CO(g)+BaS(s)△H1=+571.2kJ?mol-1 ①