题目内容
向一定量的Fe、FeO、Fe2O3的混合物中加入120mL4mol/L的稀硝酸,恰好使混合物完全溶解,放出1.344LNO(标准状况),往所得溶液中加入KSCN溶液,无红色出现。若用足量的氢气在加热下还原相同质量的混合物,能得到铁的物质的量为
| A.0.24 mol | B.0.21 mol | C.0.16 mol | D.0.14 mol |
B
解析试题分析:根据题意可知,溶液中无铁离子存在,得到的溶液为Fe(NO3)2的溶液,根据N元素守恒,Fe(NO3)2中NO3-的物质的量是0.12L×4mol/L-1.344L/22.4L/mol=0.42mol,则Fe元素的物质的量是0.42mol/2=0.21mol,再根据Fe元素守恒,所以用足量的氢气在加热下还原相同质量的混合物,能得到铁的物质的量也是0.21mol,答案选B。
考点:考查氧化还原反应的计算,守恒法的应用

 备战中考寒假系列答案
备战中考寒假系列答案铁溶于一定浓度的硝酸时,发生反应的离子方程式为:
aFe+bNO3-+cH+═dFe2++fFe3++gNO↑+hNO2↑+kH20,下列有关推断中,不正确的是( )
| A.2d+3f=3g+h |
| B.c+b=2d+3f |
| C.HNO3的氧化性强于Fe3+ |
| D.反应中每消耗5.6gFe,转移0.2mol~0.3mole- |
已知常温下在溶液中可发生如下两个离子反应:Ge4++Fe2+===Fe3++Ge3+, Sn2++2Fe3+===2Fe2++Sn4+;由此可以确定Fe2+、Ge3+、Sn2+三种离子的还原性由强到弱的顺序是
| A.Sn2+、Fe2+、Ge3+ | B.Sn2+、Ge3+、Fe2+ |
| C.Ge3+、Fe2+、Sn2+ | D.Fe2+、Sn2+、Ge3+ |
将一定量的氯气通入30 mL浓度为10.00 mol/L的氢氧化钠浓溶液中,加热少许时间后溶液中形成NaCl、NaClO、NaClO3共存体系。下列判断不正确的是
| A.与NaOH反应的氯气一定为0.15 mol |
| B.n(Na+)∶n(Cl-) 可能为7∶3 |
| C.若反应中转移的电子为n mol,则n一定大于0.15 mol |
| D.n(NaCl)∶n(NaClO)∶n(NaClO3)可能为7∶2∶1 |
根据下列事实,可知X、Y、Z、W还原性由强到弱的顺序是
① X+Y2+=X2++Y ② Z+2H2O=Z(OH)2+H2↑ ③ Z2+比X2+的氧化性弱
④Y元素最高价氧化物对应水化物的碱性比W元素最高价氧化物对应水化物的碱性强
| A.X>Z>Y>W | B.Z>W>X>Y |
| C.Z>X>Y>W | D.Z>Y>X>W |
对于反应3Cl2+6NaOH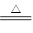 5NaCl+NaClO3+3H2O,以下叙述正确的是
5NaCl+NaClO3+3H2O,以下叙述正确的是
| A.Cl2是氧化剂,NaOH是还原剂 |
| B.当有6.72L Cl2反应时,转移电子物质的量为0.5mol |
| C.氧化剂得电子总数与还原剂失电子总数之比为1∶1 |
| D.被氧化的氯原子和被还原的氯原子的物质的量之比为5∶1 |
根据表中信息判断,下列选项正确的是( )
| A.第①组反应的其余产物为H2O |
| B.第②组反应中Cl2与FeBr2的物质的量之比小于或等于1:2 |
| C.第③组反应中生成1mol Cl2,转移电子5mol |
| D.氧化性由强到弱顺序为MnO4 >Cl2> Fe3+> Br2 |
某反应的反应物与生成物有:K2Cr2O7、KCl、CrCl3、Cl2、HCl、H2O,已知反应过程中发生如下变化:K2Cr2O7→CrCl3,则下列说法不正确的是
| A.由此反应可知氧化性K2Cr2O7>Cl2 |
| B.氧化剂和还原剂的物质的量之比为1:6 |
| C.当转移0.2mol电子时,生成的还原产物的物质的量为0.1mol |
| D.发生氧化还原反应的氯元素与参加反应的氯元素的比为3:7 |