题目内容
12.下表为元素周期表的一部分,参照元素①~⑩在表中的位置,请用化学用语作答:
(1)由①和②两种元素组成的相对分子质量为28的化合物的结构式为
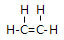 ;由元素④和元素②形成的化合物的电子式为
;由元素④和元素②形成的化合物的电子式为 ;元素⑦的原子结构示意图为
;元素⑦的原子结构示意图为 .
.(2)③、⑧、④三种元素的原子半径由大到小的顺序是P>N>O.(填元素符号)
(3)⑧、⑨、⑩三种元素的最高氧化物对应水化物酸性最强的是HClO4.(填化学式)
(4)元素③和⑧的气态氢化物稳定性较强的是NH3.(填化学式)
(5)写出元素②的单质与元素⑨的最高氧化物对应的水化物的浓溶液反应的化学方程式C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O.
(6)由④⑤⑩三种元素组成,是生活中常见的消毒剂.As可与该物质的水溶液反应,产物有As的最高价含氧酸,该反应的化学方程式为5NaClO+2As+3H2O=2H3AsO4+5NaCl.
分析 由元素在周期表中位置知①为H、②为C、③为N、④为O、⑤为Na、⑥为Mg、⑦为Al、⑧为P、⑨为S,⑩为Cl.
(1)C与H形成的相对分子质量为28的化合物为乙烯,乙烯中含有1个碳碳双键,二氧化碳为共价化合物,O与C形成2对共价键;Al原子序数为13,有3个电子层,最外层电子数为3;
(2)同周期自左而右原子半径减小,同主族自上而下原子半径增大;
(3)非金属性越强,其最高价氧化物对应的水化物的酸性越强;
(4)非金属性越强,其气态氢化物越稳定;
(5)C与浓硫酸在加热的条件下反应生成二氧化碳气体、二氧化硫气体和水;
(6)Na、O和Cl构成次氯酸钠,为常见消毒剂,据此解答即可.
解答 解:由元素在周期表中位置知①为H、②为C、③为N、④为O、⑤为Na、⑥为Mg、⑦为Al、⑧为P、⑨为S,⑩为Cl.
(1)C与H形成的相对分子质量为28的化合物为乙烯,乙烯中含有1个碳碳双键,乙烯的结构式为: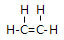 ,CO2是共价化合物,其结构式为O=C=O,碳原子和氧原子之间有2对电子,其电子式为
,CO2是共价化合物,其结构式为O=C=O,碳原子和氧原子之间有2对电子,其电子式为 ,Al原子序数为13,有3个电子层,最外层电子数为3,其结构示意图为:
,Al原子序数为13,有3个电子层,最外层电子数为3,其结构示意图为: ;故答案为:
;故答案为: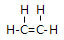 ;
; ;
; ;
;
(2)同周期原子序数越大,半径越小,同主族,原子序数越大,半径越大,故半径关系:P>N>O,故答案为:P>N>O;
(3)由于非金属性Cl>S>P,故高氯酸的酸性最强,高氯酸化学式为:HClO4,故答案为:HClO4;
(4)由于非金属性N>P,故氨气的稳定性强于磷化氢,故答案为:NH3;
(5)C与浓硫酸反应生成两种气体和水,化学反应方程式为:C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O,故答案为:C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O;
(6)生活中由Na和O和Cl构成的消毒剂为次氯酸钠,As的最高价含氧酸为砷酸,依据题给信息可知,As与次氯酸钠反应生成砷酸,结合元素守恒以及氧化还原反应得失电子守恒,得化学反应方程式为:5NaClO+2As+3H2O=2H3AsO4+5NaCl,故答案为:5NaClO+2As+3H2O=2H3AsO4+5NaCl.
点评 本题主要考查的是元素周期表的应用以元素周期律的应用,熟练掌握短周期元素是解决本题的关键,另外还考查了化学反应方程式的书写,原子结构示意图、电子式以及结构式的书写,综合性较强.

 一本好题口算题卡系列答案
一本好题口算题卡系列答案| A. | 电解法、热还原法、热分解法 | B. | 热还原法、热分解法、电解法 | ||
| C. | 热分解法、热还原法、电解法 | D. | 电解法、热分解法、热还原法 |
 在催化剂表面NH3脱硫的原理为:8NH3(g)+6SO2(g)=3S2(g)+4N2(g)+12H2O(g)△H,实验测定在不同$\frac{n(N{H}_{3})}{n(S{O}_{2})}$下,温度与SO2的转化率关系如图,下列说法正确的是( )
在催化剂表面NH3脱硫的原理为:8NH3(g)+6SO2(g)=3S2(g)+4N2(g)+12H2O(g)△H,实验测定在不同$\frac{n(N{H}_{3})}{n(S{O}_{2})}$下,温度与SO2的转化率关系如图,下列说法正确的是( )| A. | 脱硫反应△H<0 | |
| B. | 及时从体系中除去水,平衡常熟增大 | |
| C. | 相同条件下,催化剂活性越大,SO2的平衡转化率越高 | |
| D. | $\frac{n(N{H}_{3})}{n(S{O}_{2})}$:a<b<c |
| A. | CuSO4溶液 | B. | Fe(OH)3胶体 | C. | 稀硫酸 | D. | 浑浊的石灰水 |
| A. | Cl2 | B. | NO2 | C. | SO2 | D. | H2O2 |
| A. | NH4Cl | B. | Cl2 | C. | H2O2 | D. | CCl4 |
| A. | NaCl | B. | Cl2 | C. | Na和Mg | D. | NaOH和H2 |
 将反应2Fe3++Cu═2Fe2++Cu2+设计成如图所示原电池,可供选择的电解质溶液有FeCl3、CuSO4两种溶液.
将反应2Fe3++Cu═2Fe2++Cu2+设计成如图所示原电池,可供选择的电解质溶液有FeCl3、CuSO4两种溶液.