题目内容
7.如图分别是A的球棍模型和B的比例模型,回答下列问题:
(1)A的结构简式为CH3OH;
(2)工业上用乙烯与水反应可制得B,该反应的化学方程式为CH2=CH2+H2O$\stackrel{催化剂}{→}$CH3CH2OH,反应类型是加成反应;
(3)下列属于B的同系物的是c,属于B的同分异构体的是d(填字母)
a.
 b.
b.
c.CH3CH2CH2OH d.H3C-O-CH3.
分析 由球棍模型可知A为甲醇,B为乙醇,
(1)A为甲醇,据此书写结构简式;
(2)乙烯与水发生加成反应生成乙醇;
(3)结构相似,在分子组成上相差1个或多个CH2原子团的互为同系物,分子式相同,结构不同的互为同分异构体.
解答 解:由球棍模型可知A为甲醇,B为乙醇,
(1)甲醇的结构简式为CH3OH,故答案为:CH3OH;
(2)乙烯与水发生加成反应生成乙醇,化学反应方程式为:CH2=CH2+H2O$\stackrel{催化剂}{→}$CH3CH2OH,故答案为:CH2=CH2+H2O$\stackrel{催化剂}{→}$CH3CH2OH;加成反应;
(3)CH3CH2CH2OH为丙醇,与乙醇相差1个CH2原子团,两者属于同系物;H3C-O-CH3为甲醚,分子式为C2H6O,与乙醇互为同分异构体,故答案为:c;d.
点评 本题主要考查对球棍模型的认识,涉及乙醇的制取方法、同系物与同分异构体的概念,难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
17.下列物质中,既含极性共价键又含非极性共价键的化合物是( )
| A. | NH4Cl | B. | Cl2 | C. | H2O2 | D. | CCl4 |
18. 目前工业上有一种用CO2来生产燃料甲醇的方法,可以将CO2变废为宝.
目前工业上有一种用CO2来生产燃料甲醇的方法,可以将CO2变废为宝.
(1)已知在常温常压下:
①2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(g)△H=1275.6kJ•mol-1
②2CO(g)+O2(g)═2CO2(g)△H=566kJ•mol-1
③H2O(l)=H2O(g)△H=+44kJ•mol-1
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式CH3OH(l)+O2(g)=CO(g)+2H2O(l)△H=_442.8kJ•mol-1
(2)甲醇对水质会造成一定的污染,有一种电化学法可消除这种污染,实验室用如图装置模拟该过程,其原理是:通电后,Co2+被氧化成Co3+,然后以Co3+做氧化剂把甲醇氧化成CO2而除云(Co3+的还原产物是Co2+).
①写出阳极电极反应式Co2+-e-=Co3+;
②写出除云甲醇的离子方程式6Co3++CH3OH+H2O=CO2↑+6Co2++6H+.
(3)将不同量的CO(g)和H2O(g)分别通入体积为2L的恒容密闭容器中,进行反应:CO(g)+H2O(g)?CO2(g)+H2(g),得到如下三组数据:
①该反应的正反应为放(填“吸”或“放”)热反应.
②实验1中,以v(H2)表示的平均反应速率为0.16mol•(L•min)-1.
③900℃时,按CO(g)、H2O(g)、CO2(g)和H2(g)的物质的量分别是0.8mol、1.0mol、0.6mol和0.8mol分别加入该容器,则此时反应的v(正)<v(逆)(填“>”“<”或“=”之一).
④实验3跟实验2相比,改变的条件可能是使用了催化剂或增大了压强.
 目前工业上有一种用CO2来生产燃料甲醇的方法,可以将CO2变废为宝.
目前工业上有一种用CO2来生产燃料甲醇的方法,可以将CO2变废为宝.(1)已知在常温常压下:
①2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(g)△H=1275.6kJ•mol-1
②2CO(g)+O2(g)═2CO2(g)△H=566kJ•mol-1
③H2O(l)=H2O(g)△H=+44kJ•mol-1
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式CH3OH(l)+O2(g)=CO(g)+2H2O(l)△H=_442.8kJ•mol-1
(2)甲醇对水质会造成一定的污染,有一种电化学法可消除这种污染,实验室用如图装置模拟该过程,其原理是:通电后,Co2+被氧化成Co3+,然后以Co3+做氧化剂把甲醇氧化成CO2而除云(Co3+的还原产物是Co2+).
①写出阳极电极反应式Co2+-e-=Co3+;
②写出除云甲醇的离子方程式6Co3++CH3OH+H2O=CO2↑+6Co2++6H+.
(3)将不同量的CO(g)和H2O(g)分别通入体积为2L的恒容密闭容器中,进行反应:CO(g)+H2O(g)?CO2(g)+H2(g),得到如下三组数据:
| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | |
| H2O | CO | CO2 | |||
| 1 | 650 | 2 | 4 | 1.6 | 5 |
| 2 | 900 | 1 | 2 | 0.4 | 3 |
| 3 | 900 | 1 | 2 | 0.4 | 1 |
②实验1中,以v(H2)表示的平均反应速率为0.16mol•(L•min)-1.
③900℃时,按CO(g)、H2O(g)、CO2(g)和H2(g)的物质的量分别是0.8mol、1.0mol、0.6mol和0.8mol分别加入该容器,则此时反应的v(正)<v(逆)(填“>”“<”或“=”之一).
④实验3跟实验2相比,改变的条件可能是使用了催化剂或增大了压强.
15.质量相等的下列烃,在相同的条件下完全燃烧,耗氧最多的是( )
| A. | C2H2 | B. | C3H6 | C. | C4H6 | D. | C7H8 |
16.下列条件下铁钉最容易生锈的是( )
| A. | 浸泡在植物油中 | B. | 浸泡在海水中 | ||
| C. | 置于干燥的空气中 | D. | 铁钉表面涂一层油漆 |
3.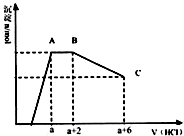 某溶液中可能含有OH-,CO32-,AlO2-,SiO32-,SO42-,K+,Na+,Fe3+,Mg2+,Al3+等离子,当向溶液中逐滴加入一定物质的量的盐酸时,生成沉淀物质的量与加入盐酸体积的关系如图,下列说法中不正确的是( )
某溶液中可能含有OH-,CO32-,AlO2-,SiO32-,SO42-,K+,Na+,Fe3+,Mg2+,Al3+等离子,当向溶液中逐滴加入一定物质的量的盐酸时,生成沉淀物质的量与加入盐酸体积的关系如图,下列说法中不正确的是( )
 某溶液中可能含有OH-,CO32-,AlO2-,SiO32-,SO42-,K+,Na+,Fe3+,Mg2+,Al3+等离子,当向溶液中逐滴加入一定物质的量的盐酸时,生成沉淀物质的量与加入盐酸体积的关系如图,下列说法中不正确的是( )
某溶液中可能含有OH-,CO32-,AlO2-,SiO32-,SO42-,K+,Na+,Fe3+,Mg2+,Al3+等离子,当向溶液中逐滴加入一定物质的量的盐酸时,生成沉淀物质的量与加入盐酸体积的关系如图,下列说法中不正确的是( )| A. | 原溶液肯定含有OH-,CO32-,AlO2-,SiO32- | |
| B. | K+和Na+至少含有其中一种 | |
| C. | n(CO32-):n(AlO2-)=3:2 | |
| D. | a值肯定大于$\frac{4}{3}$ |
 将反应2Fe3++Cu═2Fe2++Cu2+设计成如图所示原电池,可供选择的电解质溶液有FeCl3、CuSO4两种溶液.
将反应2Fe3++Cu═2Fe2++Cu2+设计成如图所示原电池,可供选择的电解质溶液有FeCl3、CuSO4两种溶液. .
. A~J为中学化学中常见的几种物质.它们有如图转化关系:
A~J为中学化学中常见的几种物质.它们有如图转化关系: