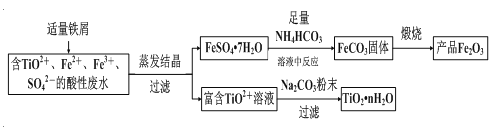
题目内容
【题目】热化学碘硫循环可用于大规模制氢气,HI分解和SO2水溶液还原I2均是其中的主要反应。回答下列问题:
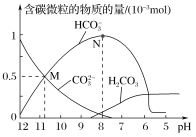
(1)碘硫热化学循环中,SO2的水溶液还原I2的反应包括:SO2+I2+2H2O![]() 3H++HSO4- +2I- 、I-+I2
3H++HSO4- +2I- 、I-+I2![]() I3-。若起始时n(I2)=n(SO2)=1mo1,I- 、I3- 、H+ 、HSO4-的物质的量随(
I3-。若起始时n(I2)=n(SO2)=1mo1,I- 、I3- 、H+ 、HSO4-的物质的量随(![]() )的变化如图所示:
)的变化如图所示:
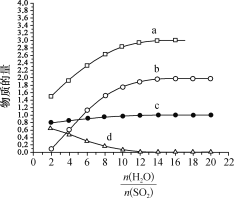
图中表示的微粒:a为_____________,d为____________________。
(2)起始时 HI的物质的量为1mo1,总压强为0.1MPa下,发生反应 HI(g) ![]()
![]() H2(g)+
H2(g)+![]() I2(g) 平衡时各物质的物质的量随温度变化如图所示:
I2(g) 平衡时各物质的物质的量随温度变化如图所示:
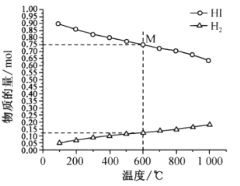
①该反应的△H __________________ (“>”或“<”)0。
②600℃时,平衡分压p(I2)= ______MPa,反应的平衡常数Kp=_____________ (Kp为以分压表示的平衡常数)。
(3)反应 H2(g)+I2(g) ![]() 2HI(g)的反应机理如下:
2HI(g)的反应机理如下:
第一步:I2![]() 2I(快速平衡)
2I(快速平衡)
第二步:I+H2![]() H2I(快速平衡)
H2I(快速平衡)
第三步:H2I+I ![]() 2HI (慢反应)
2HI (慢反应)
①第一步反应_____________ (填 “放出”或“吸收”)能量。
②只需一步完成的反应称为基元反应,基元反应如aA+dD = gG+hH 的速率方程,v= kca(A)cd(D),k为常数;非基元反应由多个基元反应组成,非基元反应的速率方程可由反应机理推定。H2(g)与I2(g)反应生成 HI(g)的速率方程为v= ________(用含k1、k-1、k2…的代数式表示)。
【答案】H+ I3- > 0.0125 ![]() (或0.167) 吸收
(或0.167) 吸收 ![]() c(H2)·c(I2)
c(H2)·c(I2)
【解析】
(1)加水稀释,SO2+I2+2H2O![]() 3H++HSO4-+2I-正向移动,I-+I2
3H++HSO4-+2I-正向移动,I-+I2![]() I3-逆向移动,同时,加水稀释后HSO4- 电离程度增大,结合图中信息,可确定曲线a表示H+、曲线b表示I-、曲线c表示HSO4-、曲线d表示I3-。从而得出图中表示的微粒:a为H+,d为I3-。答案为:H+;I3-;
I3-逆向移动,同时,加水稀释后HSO4- 电离程度增大,结合图中信息,可确定曲线a表示H+、曲线b表示I-、曲线c表示HSO4-、曲线d表示I3-。从而得出图中表示的微粒:a为H+,d为I3-。答案为:H+;I3-;
(2) ①随着温度的不断升高,HI的物质的量不断减小,H2的物质的量不断增大,则平衡正向移动,所以正反应为吸热反应,该反应的△H>0。答案为:>;
②从图中采集数据,600℃时,n(HI)=0.75mol,n(H2)=0.125mol,反应前后气体分子数不变,从而得出平衡分压p(I2)=![]() MPa=0.0125MPa,反应HI(g)
MPa=0.0125MPa,反应HI(g)![]()
![]() H2(g)+
H2(g)+![]() I2(g)的平衡常数Kp=
I2(g)的平衡常数Kp=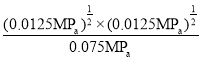 =
=![]() (或0.167)。答案为:0.0125;
(或0.167)。答案为:0.0125;![]() (或0.167);
(或0.167);
(3)①第一步反应断裂共价键,吸收能量。答案为:吸收;
②反应速率由慢反应决定,即v=k3c(H2I)·c(I),
第一步是快速平衡,k1c(I2)=k-1c2(I),可得c2(I)=![]() c(I2),
c(I2),
第二步也是快速平衡,k2c(I)·c(H2)=k-2c(H2I),可得c(H2I)=![]() c(H2)·c(I),
c(H2)·c(I),
v=k3![]() c(H2)·c(I)·c(I)= k3
c(H2)·c(I)·c(I)= k3![]() c(H2)·
c(H2)·![]() c(I2)=
c(I2)=![]() c(H2)·c(I2)。答案为:
c(H2)·c(I2)。答案为:![]() c(H2)·c(I2)。
c(H2)·c(I2)。