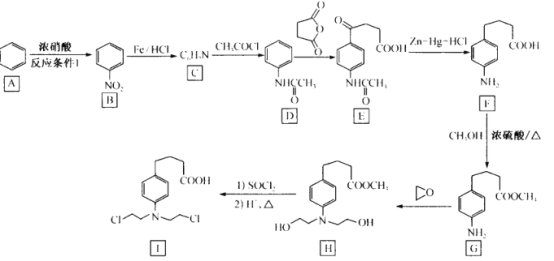
题目内容
【题目】下列说法不正确的是
A.25℃时,测得0.1mol/L的一元碱MOH溶液pH=11,则MOH一定为弱碱
B.25℃时,将pH=1的H2SO4溶液加水稀释10倍,所得溶液的c(SO42-)为0.005mol/L
C.25℃时,将![]() 的一元碱MOH溶液加水稀释至pH=10,所得溶液c(OH-)=10-4mol/L
的一元碱MOH溶液加水稀释至pH=10,所得溶液c(OH-)=10-4mol/L
D.25℃时,pH=12的一元碱MOH溶液与pH=2的盐酸等体积混合,所得溶液pH≤7
【答案】D
【解析】
A.0.1mol/L的一元碱MOH溶液pH=11,则一元碱MOH溶液中c(OH-)=10-3mol/L,所以MOH只有一部分电离,属于弱碱,A正确;
B.pH=1的H2SO4溶液中c(H+)=0.1mol/L,c(SO42-)=0.05mol/L,稀释10倍后所得溶液的c(SO42-)=0.005mol/L,B正确;
C.25℃时,MOH溶液的pH=10,则c(H+)=10-10mol/L,所得溶液c(OH-)=10-4mol/L,C正确;
D.25℃时,pH=12的一元碱MOH溶液中c(MOH)≥0.01mol/L,pH=2的盐酸溶液中c(HCl)=0.01mol/L,二者等体积混合后所得溶液pH≥7,D错误;
故合理选项是D。

练习册系列答案
相关题目