题目内容
【题目】可充电钠-CO2 电池示意图如下,放电时电池总反应为: 4Na+3CO2=2Na2CO3+C.下列说法正确的是
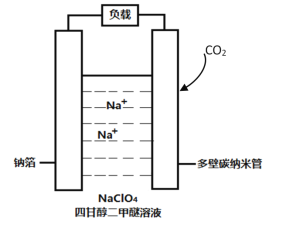
A.该电池也可用水作溶剂
B.放电时,正极的电极反应为:4Na++ 3CO2+ 4e- = 2Na2CO3+C
C.充电时,钠箔与外接电源的正极相连
D.每吸收1molCO2,理论上电路中转移4 mol e-
【答案】B
【解析】
由电池总方程式可知,钠元素化合价升高被氧化,钠箔为原电池的负极,碳元素化合价降低被还原,多壁碳纳米管为原电池的正极。
A.钠与水反应生成氢氧化钠和氢气,则该电池不能用水作溶剂,应选择有机溶剂,故A错误;
B.放电时,多壁碳纳米管为原电池的正极,二氧化碳在正极上得到电子生成碳和碳酸钠,电极反应式为4Na++ 3CO2+ 4e-= 2Na2CO3+C,故B正确;
C.放电时,钠箔为原电池的负极,则充电时,钠箔与外接电源的负极相连,故C错误;
D.由电池总方程式可知,每吸收3molCO2,理论上电路中转移4 mol e-,故D错误;
故选B。

【题目】汽车尾气中含有CO、NOx等污染物,减少汽车尾气污染是重要研究课题。
(1)已知: N2(g) + O2(g)==2NO(g) △H=+ 180.5kJ·mol-1
2C(s)+ O2(g)== 2CO(g) △H= - 221.0kJ·mol-1
C(s)+ O2(g)==CO2(g) △H= -393.5 kJ·mol-1
2CO(g)+ 2NO(g)== N2(g)+ 2CO2(g) △H=_______kJ·mol-1
(2)某温度下,为探究2CO(g)+ 2NO(g)N2(g)+ 2CO2(g)的反应速率,用气体传感器测得不同时间的CO和NO浓度如下表:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
c(CO)/10-4mol·L-1 | 36.0 | 30.5 | 28.5 | 27.5 | 27.0 | 27.0 |
c(NO)/10-4mol·L-1 | 10.0 | 4.50 | 2.50 | 1.50 | 1.00 | 1.00 |
①前2s内,上述反应的平均反应速率v(NO)=_______;
②该温度下,上述反应的平衡常数K=_________;
③对于上述反应,下列叙述正确的是________(填字母)。
A.反应在低温下能自发进行 B.当2v正(CO)=v逆(N2)时,反应达到平衡状态
C.研究反应的高效催化剂意义重大 D.反应达到平衡时,CO、NO的转化率相等
(3)CO浓度分析仪以燃料电池为工作原理,其装置如图所示,该电池中电解质为氧化钇-氧化钠,其中O2-可以在固体介质NASICON中自由移动。写出多孔电极a的电极反应式:_________。