题目内容
【题目】草酸(乙二酸)存在于自然界的植物中,是一种弱酸。草酸的钠盐和钾盐易溶于水,而其钙盐难溶于水。草酸晶体(H2C2O4·2H2O)无色,熔点为101℃,易溶于水,受热易脱水、升华、170℃以上分解。回答下列问题:
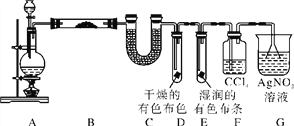
(1)甲组同学按照如图所示的装置,通过实验检验草酸晶体的分解产物。装置A中试管口略向上倾斜的原因是__________;装置C中可观察到有气泡冒出,澄清石灰水变浑浊,由此可知草酸晶体分解的产物中有______;装置B的主要作用是______________________;

(2)乙组同学认为草酸晶体分解的产物中还可能含有CO,为进行验证,选用甲组实验中的装置A、B和如图所示的部分装置进行实验。

①乙组同学的实验装置中,依次连接的顺序为A、B、F、D、G、H、D、I,其中装置H中盛有的物质是_______;第一次使用装置D的作用是___________;
②能证明草酸晶体分解产物中有CO的现象是________________。
【答案】草酸晶体熔点低,受热熔化CO2冷凝(水蒸气和草酸),防止草酸进入装置C反应生成沉淀而干扰CO2的检验CuO证明CO2已除尽H中黑色粉末变为红色,其后的D中澄清石灰水变浑浊
【解析】
(1)草酸晶体的熔点较低,受热易熔化,所以试管口向上倾斜;草酸受热分解可能生成CO2、H2O、CO,CO2能使澄清石灰水变浑浊,故在C观察到的现象为有气泡产生,澄清石灰水变浑浊;根据C中澄清石灰水变浑浊可知草酸晶体分解产物中有CO2;草酸和Ca2+反应生成难溶物草酸钙,冰水起到冷凝水蒸气和草酸的作用,防止草酸进入装置C和Ca2+反应生成沉淀,干扰CO2的检验。
(2)①要检验草酸分解产物可能存在CO,可通过先除去CO2和可能蒸发出的未分解的草酸,可将气体通入浓氢氧化钠溶液除去CO2,用澄清的石灰水检验二氧化碳气体是否除净;之后对气体进行干燥处理,则需通入无水氯化钙,然后再通入灼热的CuO,若有CO,则发生反应CO+CuO![]() Cu+CO2,再将生产的气体通入澄清石灰水中检验是否有CO2生成,由于C不一定完全反应,CO为有毒气体,则最后需连接尾气处理装置,故依次连接的合理顺序为A、B、F、D、G、H、D、I;CO和CuO反应生成CO2和Cu,故装置H的物质为为CuO。
Cu+CO2,再将生产的气体通入澄清石灰水中检验是否有CO2生成,由于C不一定完全反应,CO为有毒气体,则最后需连接尾气处理装置,故依次连接的合理顺序为A、B、F、D、G、H、D、I;CO和CuO反应生成CO2和Cu,故装置H的物质为为CuO。
②若存在CO,CO+CuO![]() Cu+CO2,H中黑色的CuO被还原为红色Cu,同时生成CO2,则D中观察到澄清石灰水变浑浊。
Cu+CO2,H中黑色的CuO被还原为红色Cu,同时生成CO2,则D中观察到澄清石灰水变浑浊。
(1)根据信息可知草酸晶体(H2C2O42H2O)熔点较低,受热后易熔化为液态,因此装置A中试管口略向上倾斜;草酸晶体(H2C2O42H2O)受热脱水、升华,170℃以上分解,分解时会产生二氧化碳,二氧化碳和氢氧化钙反应生成难溶性的碳酸钙沉淀而使澄清石灰水变浑浊,所以C中观察到的现象是:有气泡冒出且澄清石灰水变浑浊,说明有二氧化碳生成;草酸的钙盐难溶于水,草酸易升华,导致生成的气体中含有草酸,草酸和氢氧化钙反应生成难溶性的草酸钙而干扰二氧化碳的检验,B装置装有冰水,温度较低,有冷凝作用,防止干扰二氧化碳的检验;正确答案:草酸晶体熔点低,受热熔化;CO2;冷凝(水蒸气和草酸),防止草酸进入装置C反应生成沉淀而干扰CO2的检验。
(2)①要检验生成CO,在甲组实验后,用浓氢氧化钠除去二氧化碳,用澄清石灰水检验二氧化碳,用碱石灰干燥CO,利用CO和CuO发生还原反应生成CO2,再利用澄清石灰水检验生成的二氧化碳,用排水法收集CO避免环境污染,所以其连接顺序是F、D、G、H、D、I;H装置中盛放的物质应该具有氧化性,且和CO反应有明显现象发生,CuO能被CO还原且反应过程中黑色固体变为红色,现象明显,所以H中盛放的物质是CuO;草酸分解产生的气体中含有一氧化碳和二氧化碳,混合气体先通过浓的氢氧化钠溶液,除去二氧化碳,再通过澄清的石灰水,如果不变浑浊,说明二氧化碳气体已经被F吸收完全;正确答案:CuO ;证明CO2已除尽。
②CO具有还原性,其氧化产物是二氧化碳,二氧化碳能使澄清石灰水变浑浊,且CO将黑色的CuO还原为红色的Cu,H中黑色固体转化为红色且其后的D装置溶液变浑浊就说明含有CO;正确答案:H中黑色粉末变为红色,其后的D中澄清石灰水变浑浊。

【题目】已知25℃、101kPa时,一些物质的燃烧热为,回答下列问题:
化学式 | CO(g) | H2(g) | CH3OH(l) | CH4(g) |
△H/(kJ·mol-l) | -283.0 | -285.8 | -726.5 | -890.3 |
(1)写出该条件下CH3OH(l)完全燃烧的热化学方程式:_____________________________。
(2)根据盖斯定律完成下列反应的热化学方程式:CO(g)+2H2(g)![]() CH3OH(l)△H=__________。
CH3OH(l)△H=__________。
(3)工业上利用水煤气合成甲醇的主要反应可表示为![]() CO(g)+H2(g)
CO(g)+H2(g)![]()
![]() CH3OH(g)△H=-45.4kJ·mol-1。向容积为1L的密闭容器中加入0.10molH2和0.05molCO,在一定温度下发生上述反应,10min后反应达到平衡状态,测得放出热量3.632kJ。
CH3OH(g)△H=-45.4kJ·mol-1。向容积为1L的密闭容器中加入0.10molH2和0.05molCO,在一定温度下发生上述反应,10min后反应达到平衡状态,测得放出热量3.632kJ。
①相同温度条件下,上述反应的化学平衡常数K=___________。
②若容器容积不变,下列措施可增加CH3OH产率的是___________ (填标号)。
a.升高温度
b.将CH3OH(g)从体系中分离
c.充入He,使体系总压强增大
d.再充入0.10molH2和0.05molCO
e.加入催化剂
③反应达到平衡后,保持其他条件不变,若只把容器的体积缩小一半,平衡将___________(填“逆向”“正向”或“不”)移动,化学平衡常数K___________(填“增大”“减小”或“不变”)。
④温度、容积相同的甲、乙两个密闭容器,若甲中加入1molCO和2molH2,乙中加入lmolCH3OH(g),反应达到平衡时甲放出的热量为Q1kJ,乙吸收的热量为Q2kJ,甲中CO的转化率为a1,乙中CH3OH的转化率为a2,则Q1+Q2=___________,a1+a2=___________。