题目内容
【题目】现有前四周期A、B、C、D、E、X六种元素,已知B、C、D、E、A五种非金属元素原子半径依次减小,其中B的s能级上电子总数等于p能级上电子总数的2倍.X原子的M能层上有4个未成对电子.请回答下列问题: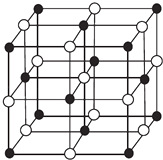
(1)写出C、D、E三种原子第一电离能由大到小的顺序为 . (用元素符号表示)
(2)A原子与B、C、D原子形成最简单化合物的稳定性由强到弱的顺序为(用分子式表示),根据价层电子对互斥理论预测BA2D的分子构型为 .
(3)某蓝色晶体,其结构特点是X2+、X3+离子分别占据六面体互不相邻的顶点,而六面体的每条棱上均有一个BC﹣ . 与A同族且相隔两个周期的元素R的离子位于立方体的恰当位置上.根据其结构特点可知该晶体的化学式为(用最简正整数表示) .
(4)科学家通过X射线探明,KCl、MgO、CaO、TiN的晶体结构与NaCl的晶体结构相似(如图所示),其中3种离子晶体的晶格能数据如下表:
离子晶体 | NaCl | KCl | CaO |
晶格能/kJmol﹣1 | 786 | 715 | 3401 |
根据表格中的数据:判断KCl、MgO、TiN三种离子晶体熔点从高到低的顺序是 . MgO晶体中一个Mg2+周围和它最邻近且等距离的O2﹣有个.
(5)研究物质磁性表明:金属阳离子含未成对电子越多,则磁性越大,磁记录性能越好.离子型氧化物V2O5和Cr2O3中,适合作录音带磁粉原料的是 .
【答案】
(1)F>N>O
(2)H2O>NH3>CH4;平面三角形
(3)KFe2(CN)6
(4)TiN>MgO>KCl;6
(5)Cr2O3
【解析】解:B的s能级上电子总数等于p能级上电子总数的2倍,B的电子排布是1s22s22p2 , 则B是碳元素;结合B、C、D、E、A五种非金属元素原子半径依次减小,根据元素周期律知元素分别是碳、氮、氧、氟、氢,即A为H、C为N、D为O、E为F.X原子的M能层上有4个未成对电子,则其价电子排布式是3d64s2 , 则X是Fe.(1)同周期主族元素,从左到右元素的第一电离能呈增大趋势,但是氮原子的2p轨道上电子半充满,较稳定,第一电离能比氧的大,故第一电离能:F>N>O,所以答案是:F>N>O;(2)元素的电负性越强,气态氢化物就越稳定,非金属性O>N>C,氢化物稳定性由强到弱的顺序为:H2O>NH3>CH4 , 根据价层电子对互斥理论,CH2O的中心原子的杂化方式为sp2杂化,为平面三角形,所以答案是:H2O>NH3>CH4;平面三角形;(3)与A同族且相隔两个周期的元素R为K元素,由题目信息,根据均摊法,晶胞中铁原子有8× ![]() =1,Fe2+、Fe3+离子各占一半,总电荷为+2.5,CN﹣为12×
=1,Fe2+、Fe3+离子各占一半,总电荷为+2.5,CN﹣为12× ![]() =3,所带电荷为﹣3,根据电中性知K+应是0.5个,故化学式为:KFe2(CN)6 , 所以答案是:KFe2(CN)6;(4)对于离子晶体,晶格能越大,熔点越高,则熔沸点TiN>MgO>KCl,MgO与NaCl晶胞结构相似,以图中体心白色球为Mg2+ , 则黑色球为O2﹣ , 1个Mg2+周围和它最邻近且等距离的O2﹣有6个,所以答案是:TiN>MgO>KCl;6;(5)V的价电子排布式是3d34s2 , 有3对孤对电子,Cr的价电子排布式是3d54s1 , 有5对孤对电子,Cr2O3含未成对电子多,则磁性大,磁记录性能越好,所以答案是:Cr2O3 .
=3,所带电荷为﹣3,根据电中性知K+应是0.5个,故化学式为:KFe2(CN)6 , 所以答案是:KFe2(CN)6;(4)对于离子晶体,晶格能越大,熔点越高,则熔沸点TiN>MgO>KCl,MgO与NaCl晶胞结构相似,以图中体心白色球为Mg2+ , 则黑色球为O2﹣ , 1个Mg2+周围和它最邻近且等距离的O2﹣有6个,所以答案是:TiN>MgO>KCl;6;(5)V的价电子排布式是3d34s2 , 有3对孤对电子,Cr的价电子排布式是3d54s1 , 有5对孤对电子,Cr2O3含未成对电子多,则磁性大,磁记录性能越好,所以答案是:Cr2O3 .

 天天向上口算本系列答案
天天向上口算本系列答案