题目内容
【题目】有关如图所示装置的叙述不正确的是( ) 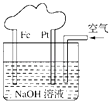
A.这是一个原电池装置
B.该装置中Pt为正极,电极反应为:O2+2H2O+4e﹣═4OH﹣
C.该装置中Fe为负极,电极反应为:Fe﹣2e﹣+2OH﹣═Fe(OH)2
D.这是电解NaOH溶液的装置
【答案】D
【解析】解:A.该装置是将化学能转变为电能的装置,属于原电池,故A正确;B.该装置中,铂作正极,正极上氧气得电子和水反应生成氢氧根离子,电极反应为:O2+2H2O+4e﹣═4OH﹣ , 故B正确;
C.该装置中,铁作负极,负极上铁失电子和氢氧根离子反应生成氢氧化亚铁,电极反应式为:Fe﹣2e﹣+2OH﹣═Fe(OH)2 , 故C正确;
D.该装置没有外接电源,属于原电池而不属于电解池,故D错误.
故选D.
该装置是铁发生吸氧腐蚀的装置,是将化学能转变为电能的装置,属于原电池,负极上铁失去电子发生氧化反应,正极上氧气得电子发生还原反应,据此分析解答.

 科学实验活动册系列答案
科学实验活动册系列答案【题目】下列关于下图实验装置的说法正确的是( )
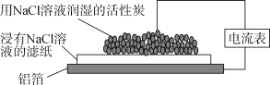
A.该装置电流表中没有电流通过
B.铝箔是正极
C.总反应为4Al+3O2+6H2O===4Al(OH)3
D.电子从铝箔流出,经电流表、活性炭、滤纸回到铝箔
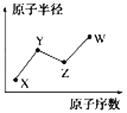
【题目】现有前四周期A、B、C、D、E、X六种元素,已知B、C、D、E、A五种非金属元素原子半径依次减小,其中B的s能级上电子总数等于p能级上电子总数的2倍.X原子的M能层上有4个未成对电子.请回答下列问题: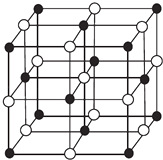
(1)写出C、D、E三种原子第一电离能由大到小的顺序为 . (用元素符号表示)
(2)A原子与B、C、D原子形成最简单化合物的稳定性由强到弱的顺序为(用分子式表示),根据价层电子对互斥理论预测BA2D的分子构型为 .
(3)某蓝色晶体,其结构特点是X2+、X3+离子分别占据六面体互不相邻的顶点,而六面体的每条棱上均有一个BC﹣ . 与A同族且相隔两个周期的元素R的离子位于立方体的恰当位置上.根据其结构特点可知该晶体的化学式为(用最简正整数表示) .
(4)科学家通过X射线探明,KCl、MgO、CaO、TiN的晶体结构与NaCl的晶体结构相似(如图所示),其中3种离子晶体的晶格能数据如下表:
离子晶体 | NaCl | KCl | CaO |
晶格能/kJmol﹣1 | 786 | 715 | 3401 |
根据表格中的数据:判断KCl、MgO、TiN三种离子晶体熔点从高到低的顺序是 . MgO晶体中一个Mg2+周围和它最邻近且等距离的O2﹣有个.
(5)研究物质磁性表明:金属阳离子含未成对电子越多,则磁性越大,磁记录性能越好.离子型氧化物V2O5和Cr2O3中,适合作录音带磁粉原料的是 .