题目内容
【题目】下列化学用语或分子结构模型表示正确的是
A.中子数为146、质子数为92的铀(U)原子![]()
B.四氯甲烷的球棍模型:![]()
C.乙烷的结构简式:CH3CH3
D.HClO的电子式:![]()
【答案】C
【解析】
A.X原子符号表示为:![]() ,其中A表示原子的质量数,Z为核内质子数,质量数=中子数+质子数,据此可知,中子数为146、质子数为92的铀(U)原子应表示为:
,其中A表示原子的质量数,Z为核内质子数,质量数=中子数+质子数,据此可知,中子数为146、质子数为92的铀(U)原子应表示为:![]() ,A项错误;
,A项错误;
B.球棍模型主要体现分子的空间构型和成键类型,但也要适当考虑原子的相对大小。题中四氯甲烷的球棍模型中C原子和Cl原子的相对大小显示不恰当,Cl原子要相对C原子大一点。B项错误;
C.结构简式为结构式的简便写法,乙烷的结构简式表示正确。C项正确;
D.H原子需要成1对共用电子对即可满足稳定结构,Cl原子最外层有7个电子,应成1对共用电子对即可满足稳定结构,O原子最外层有6个电子,应成2对共用电子对即可满足稳定结构,题中HClO的电子式书写错误,故HClO的电子式为:![]() ,D项错误;
,D项错误;
答案选C。

 教材全解字词句篇系列答案
教材全解字词句篇系列答案【题目】甲胺![]() 是合成太阳能敏化剂的原料。一定温度下,在三个体积均为
是合成太阳能敏化剂的原料。一定温度下,在三个体积均为![]() 的恒容密闭容器中按不同方式投入反应物,发生反应
的恒容密闭容器中按不同方式投入反应物,发生反应![]() ,测得有关实验数据如表,下列说法正确的是
,测得有关实验数据如表,下列说法正确的是
容器编号 | 温度 | 起始物质的量 | 平衡时物质的量 | ||||
|
|
|
| CH3NH2(g) |
| ||
Ⅰ | 530 |
|
| 0 | 0 |
| |
Ⅱ | 530 |
|
| 0 | 0 | ||
Ⅲ | 500 | 0 | 0 |
|
|
| |
A.达到平衡时,体系中![]() 关系:
关系:![]() ,Ⅰ
,Ⅰ![]() ,Ⅱ
,Ⅱ![]()
B.达到平衡时,转化率:![]() ,Ⅲ
,Ⅲ![]()
C.正反应的平衡常数![]() Ⅰ
Ⅰ![]() Ⅱ
Ⅱ![]() Ⅲ
Ⅲ![]()
D.530K时,若起始向容器Ⅰ中充入![]()
![]() 、
、![]() 、
、![]() 、
、![]()
![]() ,则反应将向逆反应方向进行
,则反应将向逆反应方向进行
【题目】高纯硫酸锰作为合成镍钴锰三元正极材料的原料,工业上可由天然二氧化锰粉与硫化锰矿(还含Fe、Al、Mg、Zn、Ni、Si等元素)制备,工艺如下图所示。回答下列问题:
相关金属离子[c0(Mn+)=0.1 mol·L1]形成氢氧化物沉淀的 pH 范围如下:
金属离子 | Mn2+ | Fe2+ | Fe3+ | Al3+ | Mg2+ | Zn2+ | Ni2+ |
开始沉淀的 pH | 8.1 | 6.3 | 1.5 | 3.4 | 8.9 | 6.2 | 6.9 |
沉淀完全的 pH | 10.1 | 8.3 | 2.8 | 4.7 | 10.9 | 8.2 | 8.9 |
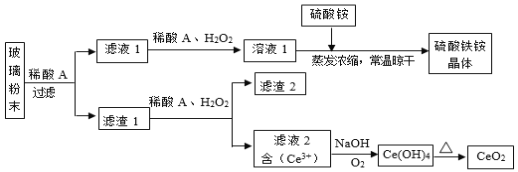
(1)“溶浸”中二氧化锰与硫化锰可以发生氧化还原反应,推测“滤渣1”含有___________ 和SiO2;
(2)“调pH”除铁和铝,溶液的pH范围应调节范围是________________之间。
(3)“除杂1”的目的是除去Zn2+和Ni2+,写出除Zn2+的方程式:__________________。
(4)“除杂2”的目的是生成MgF2沉淀除去Mg2+。若溶液酸度过高对沉淀Mg2+完全的影响是__________________(有利、不利、无影响)。
(5)在溶浸前,先把矿石研磨成粉末的原因:_______________________。
【题目】某工厂对工业污泥中的Cr元素回收与再利用的工艺如下(己知硫酸浸取液中的金属离子主要是Cr3+,其次是少量的Fe2+、Fe3+、Al3+、Ca2+、Mg2+):

部分阳离子常温下以氢氧化物形式沉淀时溶液的pH见下表:
阳离子 | Fe3+ | Fe2+ | Mg2+ | Al3+ | Cr3+ |
开始沉淀时的pH | 1.9 | 7.0 | — | 一 | — |
沉淀完全时的pH | 3.2 | 9.0 | 11.1 | 8 | 9 (>9溶解) |
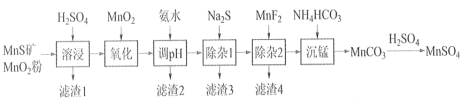
(1)实验室用98% (密度为1.84 g·cm-3)的浓硫酸配制200mL4.8 mol·L-1的硫酸溶液,配制时需要量取98%的浓硫酸的体积为_________mL (保留小数点后一位小数),所用的玻璃仪器除烧杯、玻璃棒、量筒、胶头滴管外,还需_____________________。
(2)在上述配制稀硫酸过程中,会导致所配溶液浓度偏大的操作是___________(填序号)
a. 转移溶液时,没有等溶液冷却至室温 b.量取浓硫酸时,俯视刻度线
c.当容量瓶中液体占容积2/3左右时,未振荡摇匀 d. 定容时俯视刻度线
(3)加入H2O2的作用一方面是氧化+3价Cr使之转变成+6价Cr (CrO42- 或Cr2O72-),以便于与杂质离子分离;另一方面是_____________________________。(离子方程式表示)
(4)调节溶液的pH=8除去的杂质离子是___________________。
(5)钠离子交换树脂的原理为:Mn++nNaR→MRn +nNa+,被交换的杂质离子是________________。
(6)通SO2气体时,其化学方程式为_______________________。