题目内容
【题目】全球碳计划组织(GCP,The Global Carbon Project)报告称,2018年全球碳排放量约371亿吨,达到历史新高。
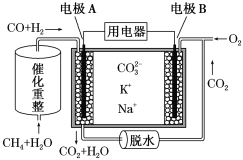
(1)中科院设计了一种新型的多功能复合催化剂,实现了CO2直接加氢制取高辛烷值汽油,其过程如图1所示。

①已知:CO2(g)+H2(g)=CO(g)+H2O(g) △H= + 41 kJ·mol-1
2CO2(g)+6H2(g)=4H2O(g)+CH2=CH2(g) △H= -128 kJ·mol-1
则上述过程中CO和H2转化为CH2=CH2的热化学方程式是_________。
②下列有关CO2转化为汽油的说法,正确的是___________________(填标号)。
A. 该过程中,CO2转化为汽油的转化率高达78%
B. 中间产物Fe5C2的生成是实现CO2转化为汽油的关键
C. 在Na-Fe3O4上发生的反应为CO2+H2=CO+H2O
D. 催化剂HZSM-5可以提高汽油中芳香烃的平衡产率
③若在一容器中充入一定量的CO2和H2,加入催化剂恰好完全反应,且产物只生成C5以上的烷烃类物质和水。则起始时CO2和H2的物质的量之比不低于_________。
(2)研究表明,CO2和H2在一定条件下可以合成甲醇。反应方程式为CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H<0。一定条件下,往2L恒容密闭容器中充入1.0molCO2和3.0molH2,在不同催化剂作用下合成甲醇,相同时间内CO2的转化率随温度变化关系如图2所示。
CH3OH(g)+H2O(g) △H<0。一定条件下,往2L恒容密闭容器中充入1.0molCO2和3.0molH2,在不同催化剂作用下合成甲醇,相同时间内CO2的转化率随温度变化关系如图2所示。
①该反应自发进行的条件是__________(填“高温”“低温”或“任意温度”)
②催化效果最佳的催化剂是__________(填“A”“B”或“C”);b点时,![]() ________
________![]() (填“>”“<”或“=”)。
(填“>”“<”或“=”)。
③若容器容积保持不变,则不能说明该反应达到化学平衡状态的是________。
a.c(CO2)与c(H2)的比值保持不变
b.v(CO2)正=v(H2O)逆
c.体系的压强不再发生变化
d.混合气体的密度不变
e.有lmolCO2生成的同时有断开3mol的H-H键
f.气体的平均相对分子质量不变
④已知容器内的起始压强为100 kPa,若图2中c点已达到平衡状态,则该温度下反应的平衡常数Kp =____________________(只列出计算式,不要求化简,Kp为以分压表示的平衡常数,分压=总压×物质的量分数)。
【答案】2CO(g)+4H2(g)=CH2=CH2(g)+2H2O(g) H=-210kJmol-1 B 6:19 低温 A > ad 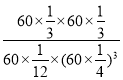
【解析】
根据已知热化学方程式运用盖斯定律书写新的热化学方程式;根据图示反应历程分析反应的中间产物,判断催化剂对反应的影响;根据烷烃的通式及题干信息进行相关计算;根据熵变和焓变判断反应是否自发进行;根据平衡状态的特征分析反应是否达到平衡状态;根据各物质的分压计算平衡常数。
(1)①已知:I CO2(g)+H2(g)=CO(g)+H2O(g) △H= + 41 kJ·mol-1,II 2CO2(g)+6H2(g)=4H2O(g)+CH2=CH2(g) △H= -128 kJ·mol-1,根据盖斯定律 II-I×2 得:2CO(g)+4H2(g)=CH2=CH2(g)+2H2O(g) △H=-128 kJ·mol-1-(+ 41 kJ·mol-1)×2=-210kJmol-1,故热化学方程式为:2CO(g)+4H2(g)=CH2=CH2(g)+2H2O(g) H=-210kJmol-1;
②A. 由图示分析78%并不是表示CO2转化为汽油的转化率,故A错误;
B. 中间产物Fe5C2是无机物转化为有机物的中间产物,是转化的关键,故B正确;
C. 根据图1所示,在Na-Fe3O4上发生的反应应为CO2生成CO的反应,氢气未参加反应,故C错误;
D. 催化剂HZSM-5的作用是加快反应速率,对平衡产率没有影响,故D错误;
故答案为:B;
③烷烃的通式为CnH(2n+2),假设只生成C6H14和水,则根据原子守恒知:6molCO2恰好完全反应生成1molC6H14和12molH2O需要的H2的物质的量为:![]() ,所以CO2和H2的物质的量之比不低于6mol:19mol=6:9,故答案为:6:9;
,所以CO2和H2的物质的量之比不低于6mol:19mol=6:9,故答案为:6:9;
(2)①该反应为放热反应,△H<0,根据方程式知:△S<0,根据ΔG=ΔH-TΔS,若ΔG<0则T较小,即低温时该反应自发进行,故答案为:低温;
②如图所示相同时间内催化剂A的转化率较高,说明反应较快催化效果好;b点时,还未达到平衡,则说明![]() >
>![]() ,故答案为:A;>;
,故答案为:A;>;
③a.c(CO2)与c(H2)初始时比值为1:3,所以按照化学计量数1:3反应后,比值始终保持不变,不能说明该反应达到平衡,故a选;
b.根据化学计量数之比知:v(CO2)正=v(H2O)正=v(H2O)逆,正逆反应速率相等,则说明已经达到平衡,故b不选;
c.该反应为气体减小的反应,所以当体系的压强不再发生变化,说明反应物和生成物浓度保持不变,能说明达到平衡状态,故c不选;
d.根据质量守恒原理知,反应前后总质量始终不变,且容器体积不变,则混合气体的密度始终不变,所以气体密度不变不能说明达到平衡,故d选;
e.断开3mol的H-H键时说明有3mol氢气消耗,则应该消耗1molCO2,则CO2的浓度保持不变,能说明达到平衡状态,故e不选;
f.反应前后气体的物质的量减小,质量保持不变,则气体的平均相对分子质量应增大,若不变,说明达到平衡状态,故f不选;
故答案为:ad;
④c点时CO2的转率为80%,则反应掉1mol×80%=0.8mol,

起始状态容器中气体总物质的量为1mol+3mol=4mol,平衡时容器中气体总物质的量为0.2mol+0.6mol+0.8mol+0.8mol=2.4mol,容器体积不变,起始压强为100 kPa,则平衡时总压强为:100kPa×![]() =60kPa,根据分压=总压×物质的量分数计算得:
=60kPa,根据分压=总压×物质的量分数计算得: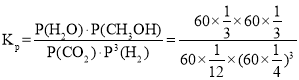 ,故答案为:
,故答案为: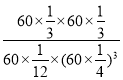 。
。

 阅读快车系列答案
阅读快车系列答案