题目内容
【题目】某工厂对工业污泥中的Cr元素回收与再利用的工艺如下(己知硫酸浸取液中的金属离子主要是Cr3+,其次是少量的Fe2+、Fe3+、Al3+、Ca2+、Mg2+):
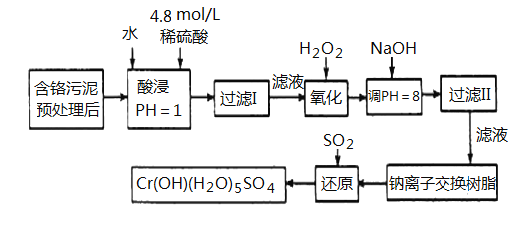
部分阳离子常温下以氢氧化物形式沉淀时溶液的pH见下表:
阳离子 | Fe3+ | Fe2+ | Mg2+ | Al3+ | Cr3+ |
开始沉淀时的pH | 1.9 | 7.0 | — | 一 | — |
沉淀完全时的pH | 3.2 | 9.0 | 11.1 | 8 | 9 (>9溶解) |
(1)实验室用98% (密度为1.84 g·cm-3)的浓硫酸配制200mL4.8 mol·L-1的硫酸溶液,配制时需要量取98%的浓硫酸的体积为_________mL (保留小数点后一位小数),所用的玻璃仪器除烧杯、玻璃棒、量筒、胶头滴管外,还需_____________________。
(2)在上述配制稀硫酸过程中,会导致所配溶液浓度偏大的操作是___________(填序号)
a. 转移溶液时,没有等溶液冷却至室温 b.量取浓硫酸时,俯视刻度线
c.当容量瓶中液体占容积2/3左右时,未振荡摇匀 d. 定容时俯视刻度线
(3)加入H2O2的作用一方面是氧化+3价Cr使之转变成+6价Cr (CrO42- 或Cr2O72-),以便于与杂质离子分离;另一方面是_____________________________。(离子方程式表示)
(4)调节溶液的pH=8除去的杂质离子是___________________。
(5)钠离子交换树脂的原理为:Mn++nNaR→MRn +nNa+,被交换的杂质离子是________________。
(6)通SO2气体时,其化学方程式为_______________________。
【答案】 65.2 250mL容量瓶 a c d 2Fe2++H2O2+2H+ = 2Fe3++2H2O Fe3+、Al3+ Ca2+、Mg2+ Na2Cr2O7+3SO2+11H2O = 2CrOH(H2O)5SO4↓+Na2SO4
【解析】(1)98% (密度为1.84 g·cm-3)的浓硫酸的物质的量浓度为![]() mol/L=18.4mol/L,实验室用98% (密度为1.84 g·cm-3)的浓硫酸,配制200mL4.8 mol·L-1的硫酸溶液,应选用250mL容量瓶配制250mL溶液,所以配制时需要量取98%的浓硫酸的体积为
mol/L=18.4mol/L,实验室用98% (密度为1.84 g·cm-3)的浓硫酸,配制200mL4.8 mol·L-1的硫酸溶液,应选用250mL容量瓶配制250mL溶液,所以配制时需要量取98%的浓硫酸的体积为![]() =65.2mL。所用的玻璃仪器除烧杯、玻璃棒、量筒、胶头滴管外,还需250mL容量瓶。
=65.2mL。所用的玻璃仪器除烧杯、玻璃棒、量筒、胶头滴管外,还需250mL容量瓶。
(2)在上述配制稀硫酸过程中,a. 转移溶液时,没有等溶液冷却至室温,定容后待冷却到室温,溶液体积会偏小,所配溶液浓度偏大;,b.量取浓硫酸时,俯视刻度线,量取浓硫酸体积偏小,所配溶液浓度偏小;c.当容量瓶中液体占容积2/3左右时,未振荡摇匀,由于水的密度小于硫酸的密度,则定容、摇匀后溶液体积偏小,浓度偏大;d. 定容时俯视刻度线,所配溶液体积偏小,浓度偏大。综上所述,会导致所配溶液浓度偏大的操作是a c d 。
(3)加入H2O2的作用一方面是氧化+3价Cr使之转变成+6价Cr (CrO42- 或Cr2O72-),以便于与杂质离子分离;另一方面是把亚铁离子氧化为铁离子以方便除杂,离子方程式为2Fe2++H2O2+2H+ = 2Fe3++2H2O。
(4)由表中数据可知,调节溶液的pH=8除去的杂质离子是Fe3+、Al3+。
(5)Fe3+、Al3+除尽后 ,还有Ca2+、Mg2+未除去,所以被交换的杂质离子是Ca2+、Mg2+。
(6)前面加入H2O2把+3价Cr氧化成+6价Cr (CrO42- 或Cr2O72-),根据产品CrOH(H2O)5SO4中铬的化合价可知,通SO2气体是为了把+6价Cr还原为+3价,所以其化学方程式为Na2Cr2O7+3SO2+11H2O = 2CrOH(H2O)5SO4↓+Na2SO4。

 阅读快车系列答案
阅读快车系列答案