题目内容
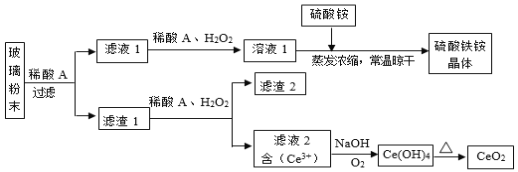
【题目】二氧化铈(CeO2)是一种重要的稀土氧化物,平板电视显示屏生产过程中产生大量的废玻璃粉末(含![]() 等物质)。某课题组以此粉末为原料,设计如下工艺流程对资源进行回收,得到纯净的CeO2和硫酸铁铵晶体。已知:CeO2不溶于稀硫酸,也不溶于NaOH溶液。
等物质)。某课题组以此粉末为原料,设计如下工艺流程对资源进行回收,得到纯净的CeO2和硫酸铁铵晶体。已知:CeO2不溶于稀硫酸,也不溶于NaOH溶液。
(1)稀酸A的分子式是___________。
(2)滤液1中加入H2O2溶液的目的是___________。
(3)设计实验证明滤液1中含有Fe2+____________。
(4)在酸性溶液中,已知Fe2+溶液可以和难溶于水的FeO(OH)反应生成Fe3O4,书写该反应的离子方程式________________。
(5)由滤液2生成![]() 的离子方程式______________。
的离子方程式______________。
(6)硫酸铁铵晶体![]() 广泛用于水的净化处理,但其在去除酸性废水中的悬浮物时效率降低,其原因是_________。
广泛用于水的净化处理,但其在去除酸性废水中的悬浮物时效率降低,其原因是_________。
(7)取上述流程中得到的![]() 产品0.832g,加硫酸溶解后,用浓度为0.1000
产品0.832g,加硫酸溶解后,用浓度为0.1000![]() 的
的![]() 标准溶液滴定至终点时(铈被还原为
标准溶液滴定至终点时(铈被还原为![]() ),消耗20.00mL标准溶液。该产品中
),消耗20.00mL标准溶液。该产品中![]() 的质量分数为___________。
的质量分数为___________。
【答案】![]() 使
使![]() 氧化为
氧化为![]() 取少许滤液1,滴加铁氰化钾溶液,有蓝色沉淀生成,则证明滤液1中有
取少许滤液1,滴加铁氰化钾溶液,有蓝色沉淀生成,则证明滤液1中有![]() Fe2++2FeO(OH)=Fe3O4+2H+ 4Ce3++O2+12OH-+2H2O=4Ce(OH)4↓ Fe3++3H2OFe(OH)3+3H+,酸性废水抑制
Fe2++2FeO(OH)=Fe3O4+2H+ 4Ce3++O2+12OH-+2H2O=4Ce(OH)4↓ Fe3++3H2OFe(OH)3+3H+,酸性废水抑制![]() 的水解(或水解平衡逆向移动),使其不能生成有吸附作用的Fe(OH)3胶体 50%
的水解(或水解平衡逆向移动),使其不能生成有吸附作用的Fe(OH)3胶体 50%
【解析】
![]() 中
中![]() 不溶于硫酸,滤渣1是
不溶于硫酸,滤渣1是![]() ,滤渣1加入还原剂H2O2,CeO2被还原为Ce3+,Ce3+与NaOH、O2反应生成Ce(OH)4,Ce(OH)4受热分解成CeO2;
,滤渣1加入还原剂H2O2,CeO2被还原为Ce3+,Ce3+与NaOH、O2反应生成Ce(OH)4,Ce(OH)4受热分解成CeO2;![]() 溶于硫酸生成硫酸铁、硫酸亚铁,滤液1含有硫酸铁、硫酸亚铁,加入H2O2,硫酸亚铁被氧化为硫酸铁,硫酸铁溶液中加入硫酸铵,蒸发浓缩、常温晾干获得硫酸铁铵晶体。
溶于硫酸生成硫酸铁、硫酸亚铁,滤液1含有硫酸铁、硫酸亚铁,加入H2O2,硫酸亚铁被氧化为硫酸铁,硫酸铁溶液中加入硫酸铵,蒸发浓缩、常温晾干获得硫酸铁铵晶体。
(1) CeO2不溶于稀硫酸,产品有硫酸铁铵,所以稀酸A是硫酸,分子式是![]() ;
;
(2) 滤液1含有硫酸铁、硫酸亚铁,加入H2O2,硫酸亚铁被氧化为硫酸铁,滤液1中加入H2O2溶液的目的是使![]() 氧化为
氧化为![]() ;
;
(3) 滤液1含有硫酸铁、硫酸亚铁,亚铁离子和铁氰化钾溶液反应生成蓝色沉淀,故取少许滤液1,滴加铁氰化钾溶液,有蓝色沉淀生成,则证明滤液1中有![]() ;
;
(4) Fe3O4中Fe2+、Fe3+的比为1:2,酸性、含有Fe2+溶液和难溶于水的FeO(OH)反应生成Fe3O4的离子方程式是Fe2++2FeO(OH)=Fe3O4+2H+;
(5)滤液2中Ce3+在氢氧化钠溶液中被氧气氧化为![]() ,反应的离子方程式4Ce3++O2+12OH-+2H2O=4Ce(OH)4↓;
,反应的离子方程式4Ce3++O2+12OH-+2H2O=4Ce(OH)4↓;
(6) 硫酸铁铵净水的原理是Fe3++3H2OFe(OH)3+3H+,酸性废水抑制![]() 的水解,使其不能生成有吸附作用的Fe(OH)3胶体,故在去除酸性废水中的悬浮物时效率降低;
的水解,使其不能生成有吸附作用的Fe(OH)3胶体,故在去除酸性废水中的悬浮物时效率降低;
(7) ![]() 加硫酸溶解后生成的Ce4+被
加硫酸溶解后生成的Ce4+被![]() 还原为
还原为![]() ,根据得失电子守恒,反应关系式是
,根据得失电子守恒,反应关系式是![]() ~Ce4+~
~Ce4+~![]() ,0.832g产品中含
,0.832g产品中含![]() 的物质的量是0.02L×0.1
的物质的量是0.02L×0.1![]() =0.002mol,该产品中
=0.002mol,该产品中![]() 的质量分数为
的质量分数为![]() =50%。
=50%。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案