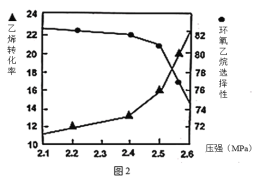
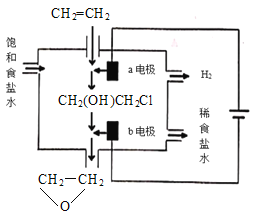
题目内容
【题目】下列事实能用勒夏特列原理解释的是
A.加入催化剂有利于合成氨的反应
B.由 H2(g)、I2(g)和 HI(g)组成的平衡体系加压后颜色变深
C.500 ℃时比室温更有利于合成氨的反应
D.光照新制的氯水时,溶液的 pH 逐渐减小
【答案】D
【解析】
勒夏特列原理为:如果改变影响平衡的条件之一,平衡将向着能够减弱这种改变的方向移动;
使用勒夏特列原理时,研究对象必须为可逆反应,否则勒夏特列原理不适用;
催化剂只能改变反应速率,不会影响化学平衡,所以不能用勒夏特列原理解释。
A.催化剂只能同等程度地改变正逆反应速率,对化学平衡无影响,不能用勒夏特列原理解释,故A不选;
B.由H2、I2(g)、HI气体组成的平衡,反应前后气体体积不变,减压后平衡不动,体积增大颜色变浅,不能用勒夏特列原理解释,故B不选;
C.合成氨反应为放热反应,升高温度不利用平衡向正方向移动,但升温却可提高反应速率,不可用勒夏特列原理解释,故C不选;
D. 光照新制的氯水时,2HClO![]() 2HCl+O2↑,Cl2+H2O
2HCl+O2↑,Cl2+H2O![]() HClO+HCl,平衡正向移动,溶液的 pH 逐渐减小,可以用平衡移动原理解释,故D选;
HClO+HCl,平衡正向移动,溶液的 pH 逐渐减小,可以用平衡移动原理解释,故D选;
故选D。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】已知常温下浓度为0.1mol/L的几种溶液的pH如右下表。下列有关说法正确的是( )
溶质 | pH |
NaF | 7.5 |
Na2CO3 | 11.6 |
NaClO | 9.7 |
NaHCO3 | 8.3 |
A. 同温度同浓度下,酸由强到弱的顺序为:HF>H2CO3>HClO
B. 水解方程式:F-+H2O![]() HF+OH-的平衡常数为1×10-13
HF+OH-的平衡常数为1×10-13
C. 将CO2通入0.lmol/LNa2CO3溶液至溶液呈中性,则溶液中:2c(CO32-)+c(HCO3-)=0.1mol/L
D. 等物质的量的NaF和HF混合溶液中粒子浓度大小关系为:c(HF)>c(Na+)>c(F-)>c (H+)>c(OH-)
【题目】某研究性学习小组利用H2C2O4溶液和酸性KMnO4溶液之间的反应来探究“外界条件改变对化学反应速率的影响”,实验如下:(不考虑溶液混合所引起的体积缩小)
实验 序号 | 实验温度/K | 参加反应的物质 | 溶液颜色褪至无色时所需时间/s | ||||
KMnO4溶液(含硫酸) | H2C2O4溶液 | H2O | |||||
V/mL | c/mol·L-1 | V/mL | c/mol·L-1 | V/mL | |||
A | 293 | 2 | 0.02 | 4 | 0.1 | 0 | 6 |
B | T1 | 2 | 0.02 | 3 | 0.1 | V1 | 8 |
C | 313 | 2 | 0.02 | V2 | 0.1 | 1 | t1 |
(1)通过实验A、B,可探究出浓度的改变对反应速率的影响,其中V1=_________,T1=_______;通过实验___________可探究出温度变化对化学反应速率的影响。
(2)C组实验中液褪色时间t1______(填“>”或“<”)8s,C组实验的反应速率v(KMnO4) = _________________。(用含有t1的式子表示)
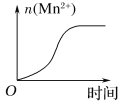
(3)该小组的一位同学通过查阅资料发现,上述实验过程中n(Mn2+)随时间变化的趋势如图所示,并以此分析造成n(Mn2+)突变的可能的原因是:______________。