题目内容
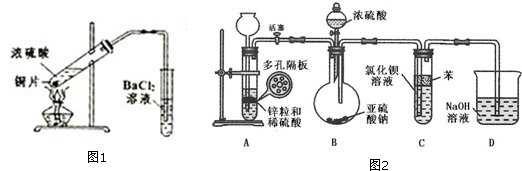
5.(1)某校研究性学习小组同学用如图1所示实验时发现BaCl2溶液中出现白色沉淀,且白色沉淀不溶于盐酸.二氧化硫通入氯化钡溶液中理论上不产生沉淀,实际因受到空气和溶液中氧气的影响而产生沉淀.①写出加热时试管中发生反应的化学方程式Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O.
②用离子方程式表示生成该白色沉淀的原因:2Ba2++2SO2+O2+2H2O=2BaSO4↓+4H+.
(2)为了避免产生沉淀,某化学小组设计了如图2所示的实验装置.请回答下列问题:
①检查装置A气密性的方法是关闭活塞,向长颈漏斗中加水,直至形成一段水柱,和试管内液面产生高度差,一段时间内高度差不变化,说明气密性良好;
②装置B中反应开始前,应进行的操作是检验D装置中导管冒出的氢气纯度;
③装置C中苯的作用是将BaCl2溶液与空气隔离,防止H2SO3被氧化全;
④装置B中反应结束后,需再打开装置A中活塞,将产生的氢气导入后续装置一段时间,目的是赶尽装置中的SO2使其被D中NaOH溶液吸收,防止污染空气;
⑤一同学取实验后的C中溶液少许,滴加一种无色溶液,也产生不溶于盐酸的白色沉淀,滴加的试剂不可能是下列物质中的ABD,
A、NaOH溶液 B、新制氯水 C、H2O2溶液 D、酸性KMnO4溶液
⑥若D中NaOH溶液恰好完全反应生成NaHSO4溶液,写出该溶液中的平衡方程式H2O?H+OH-、HSO3-?H++SO32-、HSO3-+H2O?H2SO3+OH-,该溶液呈酸性,则溶液中离子浓度大小顺序为c(Na+)>c(HSO3-)>c(H+)>c(SO32-)>c(OH-).
分析 (1)①加热条件下,Cu和浓硫酸发生氧化还原反应生成硫酸铜、二氧化硫和水;
②二氧化硫、氧气、水和钡离子反应生成硫酸钡沉淀和稀硫酸;
(2)①利用压强差检验装置的气密性;
②B中充入氢气的目的是排出氧气对二氧化硫的干扰,所以装置B中反应开始前要检验氢气纯度;
③苯能隔绝氯化钡溶液和空气接触;
④二氧化硫有毒,用氢气将装置中二氧化硫排尽;
⑤滴加无色溶液,所以要排除有色溶液,二氧化硫具有还原性,能被强氧化性物质氧化生成硫酸根离子,硫酸根离子和钡离子反应生成硫酸钡沉淀;
⑥NaHSO3溶液存在H2O的电离、NaHSO3的电离和水解三个平衡;溶液显酸性,电离大于水解,亚硫酸氢根离子水解和电离程度都较小,钠离子不水解,据此判断离子浓度大小.
解答 解:(1)①加热条件下,Cu和浓硫酸发生氧化还原反应生成硫酸铜、二氧化硫和水,化学方程式为Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O,
故答案为:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O;
②亚硫酸钡能溶于稀盐酸,所以生成的沉淀只能是硫酸钡,二氧化硫、氧气、水和钡离子反应生成硫酸钡沉淀和稀硫酸,离子方程式为2Ba2++2SO2+O2+2H2O=2BaSO4↓+4H+,
故答案为:2Ba2++2SO2+O2+2H2O=2BaSO4↓+4H+;
(2)①利用压强差检验装置的气密性,其检验方法是关闭活塞,向长颈漏斗中加水,直至形成一段水柱,和试管内液面产生高度差,一段时间内高度差不变化,说明气密性良好,
故答案为:关闭活塞,向长颈漏斗中加水,直至形成一段水柱,和试管内液面产生高度差,一段时间内高度差不变化,说明气密性良好;
②二氧化硫在水溶液中易被氧气氧化生成硫酸,所以B中充入氢气的目的是排出氧气对二氧化硫的干扰,则装置B中反应开始前要检验氢气纯度,
故答案为:检验D装置中导管冒出的氢气纯度;
③苯密度比水小,在氯化钡溶液的上层,可以起到隔离空气的作用,故答案为:将BaCl2溶液与空气隔离,防止H2SO3被氧化;
④二氧化硫有毒,为了防止造成污染,在实验结束时要再次打开活塞,将产生的氢气导入后续装置一段时间,让SO2全部被氢氧化钠吸收以防止污染,
故答案为:赶尽装置中的SO2使其被D中NaOH溶液吸收,防止污染空气;
⑤从实验结果看,应该加入的是具有氧化性的溶液,又因该溶液为无色,故为H2O2溶液,故选ABD;
⑥NaHSO3溶液存在H2O的电离、NaHSO3的电离和水解三个平衡,平衡方程式为H2O?H+OH-、HSO3-?H++SO32-、HSO3-+H2O?H2SO3+OH-;
溶液显酸性,则c(H+)>c(OH-),电离大于水解,且水还电离出氢离子,钠离子不水解,亚硫酸氢根离子电离和水解程度都较小,所以溶液中离子浓度大小顺序是c(Na+)>c(HSO3-)>c(H+)>c(SO32-)>c(OH-),
故答案为:H2O?H+OH-、HSO3-?H++SO32-、HSO3-+H2O?H2SO3+OH-;c(Na+)>c(HSO3-)>c(H+)>c(SO32-)>c(OH-).
点评 本题考查性质实验方案评价,侧重考查学生分析、判断及基本操作能力,明确实验原理及物质性质是解本题关键,知道流程图中各个仪器作用及实验目的,难点是离子浓度大小比较,题目难度中等.

 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案| A. | ZnC2水解生成乙烷 | B. | Al4C3水解生成丙炔 | ||
| C. | Mg2C3水解生成丙炔 | D. | Li2C2水解生成乙烯 |
| A. | 原子晶体的熔点一定比金属晶体的高 | |
| B. | 分子晶体的熔点一定比金属晶体的低 | |
| C. | 晶体内部的微粒按一定规律周期性的排列 | |
| D. | 凡有规则外形的固体一定是晶体 |
| A. | Na2O2能与CO2反应,可用作呼吸面具的供氧剂 | |
| B. | 硅是半导体材料,可用于制备光导纤维 | |
| C. | 明矾能水解生成Al(OH)3胶体,可用作净水剂 | |
| D. | Al2O3熔点高,可用于制作耐高温仪器 |
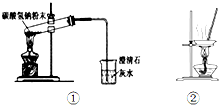
| A. | 用图①所示装置做碳酸氢钠固体受热分解实验 | |
| B. | 用装置②蒸干氯化镁溶液制MgCl2•6H2O | |
| C. | 锥形瓶可用作加热的反应器,滴定时不得用待测溶液润洗 | |
| D. | 配制溶液定容时,俯视容量瓶刻度会使溶液浓度偏低 |
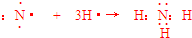 .
.