题目内容
6. 燃料电池具有广阔的发展前途,该电池有望取代传统电池,下图为某学生在实验室利用碱性氢氧燃料电池电解X溶液.
燃料电池具有广阔的发展前途,该电池有望取代传统电池,下图为某学生在实验室利用碱性氢氧燃料电池电解X溶液.请根据图示回答下列问题:
(1)在碱性氢氧燃料电池中,通入H2的电极为负极,电极反应式为2H2-4e-+4OH-=2H2O;
(2)a,b为碳棒,若X为CuSO4溶液,a极为阳极,电极反应式为4OH--4e-=2H2O+O2↑,溶液的PH变小(填“变大”,“变小”或“无影响”);若X为NaCl溶液,在U型管两端各滴入几滴的酚酞,电解总反应式为2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+H2↑+Cl2↑,b电极现象为生成气体且溶液变红色.
(3)若要实现在铁表面镀上银,则b电极为铁(填电极材料),电极反应式为Ag++e-=Ag.反应过程中消耗标准状况下O2 2.24L,则铁表面镀上银的质量为43.2g.
分析 氢氧燃料电池中通入氢气的一极为原电池的负极,发生氧化反应,通入氧气的一极为原电池的正极,发生还原反应,电池总反应为2H2+O2=2H2O,电解池中a为阳极,发生氧化反应,b为阴极,发生还原反应,若X为CuSO4溶液,则a极生成氧气,b极生成铜,要实现在铁表面镀上银,银为阳极,铁为阴极,以此解答该题.
解答 解:(1)在碱性氢氧燃料电池中,通入H2的电极为负极,发生反应为2H2-4e-+4OH-=2H2O,故答案为:负;2H2-4e-+4OH-=2H2O;
(2)a,b为碳棒,若X为CuSO4溶液,a极连接原电池的正极,为电解池的阳极,电极反应式为4OH--4e-=2H2O+O2↑,溶液的阴极发生Cu2++2e-═Cu,则溶液的pH减小;若X为NaCl溶液,在U型管两端各滴入几滴的酚酞,阳极发生2Cl--2e-=Cl2↑,阴极发生2H++2e-=H2↑,电解总反应式为 2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+H2↑+Cl2↑;b为阴极,生成OH-,电极现象为生成气体且溶液变红色,
故答案为:阳;4OH--4e-=2H2O+O2↑;变小;2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+H2↑+Cl2↑;生成气体且溶液变红色;
(3)要实现在铁表面镀上银,银为阳极,铁为阴极,b为阴极,电极方程式为Ag++e-=Ag,反应过程中消耗标准状况下O2 2.24L,即0.1mol,由O2-4e-+2H2O=4OH-可知,转移0.4mol电子,则生成0.4molAg,质量为0.4mol×108g∥mol=43.2g,
故答案为:铁;Ag++e-=Ag;43.2.
点评 本题综合考查原电池、电解池知识,为高频考点,侧重于学生的分析能力的考查,注意把握原电池的电极方程式的书写方法,答题时注意体会,难度中等.

| A. | KClO3在反应中得到电子 | |
| B. | ClO2是氧化产物 | |
| C. | H2C2O4在反应中被氧化 | |
| D. | 1 molKClO3参加反应有1mol电子转移 |
| A. | Fe3O4溶于足量稀HNO3:Fe3O4+8H+═Fe2++2Fe3++4H2O | |
| B. | NH4HCO3溶液与足量Ba(OH)2溶液混合:HCO3+Ba2++OH-═BaCO3↓+H2O | |
| C. | 向澄清石灰水中通入过量CO2:OH-+CO2═HCO3- | |
| D. | 将0.1mol/L的NH4Al(SO4)2溶液与0.3mol/L的Ba(OH)2溶液等体积混合:2Al3++3SO42-+3Ba2++6OH-═2Al(OH)3↓+3BaSO4↓ |
| A. | 电池工作时,锌失去电子 | |
| B. | 电池工作时,电子由正极通过外电路流向负极 | |
| C. | 电池正极的电极反应式为:2MnO2+H2O+2e-═Mn2O3+2OH- | |
| D. | 外电路中每通过0.2 mol电子,锌的质量理论上减小6.5 g |
| 名称 | 硫代硫酸钠 | 多硫化钙 | 过氧化钡 | 超氧化钾 |
| 化学式 | Na2S2O3 | CaSx | BaO2 | KO2 |
| A. | 三硫代碳酸钾 | B. | 多硫碳酸钾 | C. | 过硫碳酸钾 | D. | 超硫碳酸钾 |
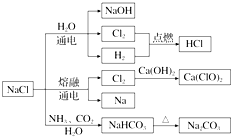
| A. | 25℃时,NaHCO3在水中的溶解度比Na2CO3的大 | |
| B. | 石灰乳与Cl2的反应中,Cl2既是氧化剂,又是还原剂 | |
| C. | 常温下干燥的Cl2能用钢瓶贮运,所以Cl2在任何条件下都不与铁反应 | |
| D. | 图示转化反应都是氧化还原反应 |
 有A、B、C、D、E、F六种物质,它们的相互转化关系如图(反应条件及部分产物乙略).已知A、B、E均为单质,B、E在常温下为气体,C为淡黄色固体.回答下列问题:
有A、B、C、D、E、F六种物质,它们的相互转化关系如图(反应条件及部分产物乙略).已知A、B、E均为单质,B、E在常温下为气体,C为淡黄色固体.回答下列问题: