题目内容
18.(1)要除去MgCl2酸性溶液里少量的Fe3+,可选用的试剂是ABD(填序号).A. MgO B.MgCO3 C.NaOH D.Mg(OH)2 E.Fe(OH)3
(2)某温度下纯水中C(H+)=2×10-7 mol/L,则此时C(OH-)=2×10-7mol/L;若温度不变,滴入稀盐酸使C(H+)=5×10-6 mol/L,则此时溶液中的C(OH-)=8×10-9mol/L.
(3)某温度下纯水的c(H+)=1.0×10-6 mol•L-1,在此温度下,将pH=8的Ba(OH)2与pH=5的稀盐酸混合,欲使pH=7,则Ba(OH)2与稀盐酸的体积比为1:10.
分析 (1)除去MgCl2酸性溶液里少量的Fe3+,加含Mg元素的不溶性固体促进铁离子水解;
(2)水电离的C(H+)=C(OH-),离子积为4×10-14,温度不变,Kw不变;
(3)某温度下纯水的c(H+)=1.0×10-6 mol•L-1,Kw=1×10-12,使pH=7,则n(H+)=n(OH-),以此计算.
解答 解:(1)除去MgCl2酸性溶液里少量的Fe3+,加含Mg元素的不溶性固体促进铁离子水解,则A、B、D均可促进铁离子水解转化为沉淀,从而除去,故答案为:ABD;
(2)水电离的C(H+)=C(OH-),离子积为4×10-14,温度不变,Kw不变,滴入稀盐酸使C(H+)=5×10-6 mol/L,则此时溶液中的C(OH-)=$\frac{4×1{0}^{-14}}{5×1{0}^{-6}}$=8×10-9mol/L,故答案为:2×10-7 mol/L;8×10-9mol/L;
(3)某温度下纯水的c(H+)=1.0×10-6 mol•L-1,Kw=1×10-12,使pH=7,则n(H+)=n(OH-),即V酸×10-5=V碱×$\frac{1{0}^{-12}}{1{0}^{-8}}$,解得Ba(OH)2与稀盐酸的体积比为1:10,故答案为:1:10.
点评 本题考查混合物的分离提纯及pH的计算,为高频考点,把握盐类水解及应用、pH与浓度的计算等为解答的关键,侧重分析与计算能力的考查,注意化学反应原理的应用,题目难度不大.

练习册系列答案
相关题目
15.在恒温时,一固定容积的容器内通入1mol PCl5(g)发生如下反应:PCl5(g)?PCl3(g)+Cl2(g) 达到平衡时,再向容器内通入一定量的PCl5(g),重新达到平衡后,与第一次平衡时相比,PCl5的体积分数( )
| A. | 增大 | B. | 减小 | C. | 不变 | D. | 无法判断 |
9.将一定量的镁铝合金放入一定量的盐酸中,合金恰好全部溶解,向所得溶液中滴加一定浓度的NaOH溶液,加入的NaOH溶液的体积(V)与沉淀质量(m)的关系如图所示.下面说法正确的是( )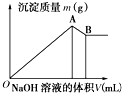

| A. | A点的沉淀是Mg(OH)2、Al(OH)3 | B. | B点的沉淀是Mg(OH)2、Al(OH)3 | ||
| C. | B点的沉淀是Al(OH)3 | D. | A点的沉淀是Mg(OH)2 |
13.下列离子方程式或化学反应方程式与所述事实相符且正确的是( )
| A. | 将少量SO2气体通入NaClO溶液中:SO2+H2O+2ClO-=SO32-+2HClO | |
| B. | 将2molSO3气体通入一密闭容器中,达平衡后吸收QkJ热量,则该反应的热化学方程式为:2SO3(g)?2SO2(g)+O2(g)△H=+Q kJ/mol | |
| C. | 向含有0.4 mol FeBr2的溶液中通入0.3 mol Cl2充分反应:4Fe2++2Br-+3Cl2=4Fe3++6Cl-+Br2 | |
| D. | 用惰性电极电解MgCI2溶液:2 Cl-+2H2O=CI2↑+H2↑+2OH- |
3.关于钠的叙述不正确的是( )
| A. | 钠质软,其新切的表面容易失去光泽 | |
| B. | 钠是电和热的良导体 | |
| C. | 钠保存在煤油中,是因为钠的密度比煤油小 | |
| D. | 钠在空气中燃烧发出黄色火焰 |
10.对某些离子的检验及结论一定正确的是( )
| A. | 加入Ba(NO3)2溶液,生成白色沉淀,加稀盐酸沉淀不消失,则原溶液中一定有SO42- | |
| B. | 通入Cl2后,溶液变为黄色,加入淀粉后溶液变蓝,则原溶液中一定有I- | |
| C. | 加入碳酸钠溶液有白色沉淀生成,再加盐酸,沉淀消失,则原溶液中一定有Ba2+ | |
| D. | 加入NaOH溶液并加热,产生使湿润的蓝色石蕊试纸变红的气体,则原溶液一定有NH4+ |
8.NA表示阿伏加德罗常数的值,下列有关说法正确的是( )
| A. | 常温常压下,16g14CH4所含中子数目为8NA | |
| B. | 标准状况下,7.8g苯中含碳碳双键的数目为0.3 NA | |
| C. | 含0.2NA个阴离子的Na2O2和水完全反应转移0.2mol电子 | |
| D. | 0.1L 3mol•L-1的NH4NO3溶液中含有的NH4+数目为0.3N |
 燃料电池具有广阔的发展前途,该电池有望取代传统电池,下图为某学生在实验室利用碱性氢氧燃料电池电解X溶液.
燃料电池具有广阔的发展前途,该电池有望取代传统电池,下图为某学生在实验室利用碱性氢氧燃料电池电解X溶液. .
.