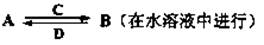题目内容
下表为元素周期表的一部分,请参照元素①-⑨在表中的位置,用化学用语回答下列问题:
| 族 周期 | IA | | 0 | |||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | | | | ② | ③ | ④ | | |
| 3 | ⑤ | | ⑥ | ⑦ | | ⑧ | ⑨ | |
(1)④、⑤、⑥简单离子半径由大到小的顺序为_________________________。
(2)⑦、⑧、⑨的最高价含氧酸的酸性由强到弱的顺序是_________________________。
(3)由表中①④元素的原子按1:1组成的化合物的稀溶液易被催化分解,通常使用的催化剂为(填序号)____________________。
a.MnO2 b.FeCl3 c.Na2SO3 d.KMnO4
(4)下图中 A~F是由部分上表中元素组成的单质或化合物,其中A、B、C为单质,转化关系如下:
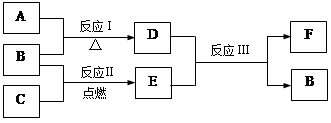
I.若B为黄色固体,A为原子半径最小的原子组成的单质,C为双原子分子组成的单质,E能使品红溶液褪色。
①F的电子式为 。
②实验测得起始参加反应的B和最后生成的B质量相等,则起始参加反应的A和C的物质的量之比是 。
II.若D为淡黄色固体,焰色反应为黄色,组成C的元素的原子最外层电子数是内层电子数的2倍。
①下列关于D的说法正确的是 (填字母)。
a.能与水发生化合反应
b.既有氧化性,又有还原性
c.既含离子键,又含非极性共价键
d.是一种碱性氧化物
②用惰性电极将F的饱和溶液进行电解,则阳极反应式是 。
(共13分)
(1)O2- > Na+> Al3+(2分)
(2)HClO4 > H2SO4 > H2SiO3(2分)
(3) a、b(2分)
(4)I.①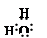 (2分)
(2分)
② 2 : 1(2分)
II.① b、c (2分)
②4OH--4e-= 2H2O+O2↑(1分)
解析试题分析:⑴O2- 、 Na+、 Al3+具有相同的电子排布,原子序数大的离子半径小,则的半径小,答案为:O2- > Na+> Al3+⑵因非金属性Cl>S>Si,则最高价含氧酸的酸性由强到弱的顺序为HClO4>H2SO4>H2SiO3, 故答案为:HClO4>H2SO4>H2SiO3 ⑶①与④组成H2O2,其分解可用MnO2、FeCl3等作催化剂,故答案:a、b;⑷I.若B为黄色固体,是S,A为原子半径最小的原子组成的单质H2,C为双原子分子组成的单质O2,SO2能使品红溶液褪色,F为H2O,①电子式为: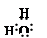 ;H2+S
;H2+S H2S,S+O2
H2S,S+O2 SO2,2H2S+SO2=3S+2H2O,生成3molS,要1molSO2,2H2S,即②H2和O2的比为2:1;答案:①F电子式为:
SO2,2H2S+SO2=3S+2H2O,生成3molS,要1molSO2,2H2S,即②H2和O2的比为2:1;答案:①F电子式为: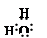 ;②H2和O2的比为2:1;
;②H2和O2的比为2:1;
II.D为淡黄色固体,焰色反应为黄色,D为Na2O2,组成C的元素的原子最外层电子数是内层电子数的2倍,为C。B为O2,A为Na,E为CO2,F为Na2CO3,①D为Na2O2,a、不正确,2Na2O2+2H2O=4NaOH+O2↑,b、正确,-1价的氧化合价可能升高,也可能降低;c、正确,Na+与O22―之间是离子键,两个氧原子之间形成非极性共价键;d、不正确,Na2O2与酸反应生成盐和水外还有氧气。答案:b c 。②用惰性电极将Na2CO3的饱和溶液进行电解,实质上是电解水,则阳极反应式是4OH--4e-= 2H2O+O2↑,答案:4OH--4e-= 2H2O+O2↑。
考点 :元素周期表、元素及其化合物

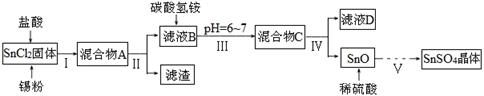
过氧化钙晶体[CaO2·8H2O]较稳定,呈白色,微溶于水,能溶于酸性溶液。广泛应用于环境杀菌、消毒等领域。
★过氧化钙晶体的制备
工业上生产CaO2·8H2O的主要流程如下: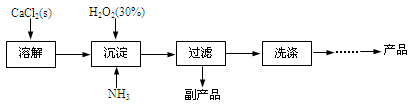
(1)用上述方法制取CaO2·8H2O的化学方程式是 。
(2)沉淀时常用冰水控制温度在10℃以下和通入过量的NH3,其可能原因分别是
① ;② 。
★过氧化钙晶体含量的测定
准确称取0.3000g产品于锥形瓶中,加入30 mL蒸馏水和10 mL 2.000 mol·L-1 H2SO4,用0.0200 mol·L—1KMnO4标准溶液滴定至终点。重复上述操作两次。H2O2和KMnO4反应的离子方程式为2MnO4-+5 H2O2+6H+ =2Mn2++5O2↑+8H2O
(3)滴定终点观察到的现象为 。
(4)根据表1数据,计算产品中CaO2·8H2O的质量分数(写出计算过程)
| 滴定次数 | 样品的质量/g | KMnO4溶液的体积/mL | |
| 滴定前刻度/mL | 滴定后刻度/mL | ||
| 1 | 0.3000 | 1.02 | 24.04 |
| 2 | 0.3000 | 2.00 | 25.03 |
| 3 | 0.3000 | 0.20 | 23.24 |
下列说法正确的是
①11H、21H、31H为三种不同的核素 ②11H、21H、31H互为同位素
③11H、21H、31H互为同素异形体 ④11H、21H、31H同系物 ⑤11H、21H、31H同分异构体
⑥同位素的“同位”指核素的质子数相同,在元素周期表中占相同的位置
⑦互为同位素的原子性质相同
| A.①②⑥ | B.①②③⑥ | C.①②⑥⑦ | D.①②③⑥⑦ |
下图是周期表中短周期的一部分。已知X原子最外层电子数比次外层电子数少3个,Z的单质是黄绿色气体。则下列说法中正确的是
| | W | |
| X | Y | Z |
A.X的氢化物比Z的氢化物稳定
B.原子半径的大小顺序是 X >Y> W
C.X、Y、Z各元素最高价和最低价的绝对值之和为8
D.X、Y、Z最高价氧化物对应水化物的酸性强弱关系X > Y> Z
下列有关元素周期表的说法中,正确的是
| A.能生成碱的金属元素都在ⅠA族 |
| B.原子序数为14的元素位于元素周期表的第3周ⅥA族 |
| C.稀有气体元素原子的最外层电子数为2或8 |
| D.元素周期表有18个纵行,分列16个族,即7个主族、8个副族和1个0族 |