题目内容
17.完成下列要求:(1)用双线桥标出下列反应中电子转移的方向和数目:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O
(2)配平方程式:2KMnO4+5H2O2+3H2SO4═1K2SO4+2MnSO4+8H2O+5O2
(3)写出实验室检验铵盐(以氯化铵与氢氧化钠反应为例)的化学方程式:NaOH+NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$NaCl+NH3↑+H2O.
(4)写出与Ne原子层结构相同的-2价阴离子的微粒的结构示意图
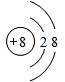 .
.(5)固体Na2SO4中可能含KCl,设计实验加以检验,写出实验方案.
分析 (1)该氧化还原反应中,得电子的元素是硫,化合价降低2价,失电子的元素是铜,化合价升高2价,所以转移电子2mol;
(2)根据氧化还原反应中得失电子数相等判断方程式;
(3)氯化铵与氢氧化钠反应生成氯化钠、水和氨气;
(4)与Ne原子电子层结构相同的-2价阴离子是氧离子;
(5)判断是否含有KCl,检验其中是否含有钾离子,可以用焰色反应进行确定,检验其中是否含有氯离子,可以用硝酸酸化的硝酸银溶液进行确定.
解答 解:(1)氧化还原反应中,得电子的元素是硫,化合价降低2价,失电子的元素是铜,化合价升高2价,所以转移电子2mol;表示方法为: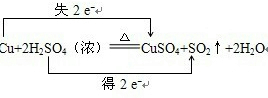 ,故答案为:
,故答案为: ;
;
(2)反应中物质的化合价变化:KMnO4→MnSO4,Mn元素化合价由+7价→+2价,一个KMnO4分子得5个电子;H2O2→O2,O由-1价变成0价,一个H2O2分子失去2个电子,所以其最小公倍数为10,故高锰酸钾的计量数为2,双氧水的计量数为5,然后根据原子守恒配平其它元素,所以其方程式为:2KMnO4+5H2O2+3H2SO4=1K2SO4+2MnSO4+8H2O+5O2,
故答案为:2;5;3;1;2;8;5;
(3)氯化铵与氢氧化钠反应生成氯化钠、水和氨气,方程式为:NaOH+NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$NaCl+NH3↑+H2O,故答案为:NaOH+NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$NaCl+NH3↑+H2O;
(4)与Ne原子电子层结构相同的-2价阴离子是氧离子,氧离子结构示意图 ,故答案为:
,故答案为: ;
;
(5)判断是否含有KCl,检验其中是否含有钾离子,可以用焰色反应进行确定,将固体混合物溶于水配成溶液,取少量溶液与试管中,用洁净的铂丝蘸取溶液在无色火焰上灼烧,若透过蓝色钴玻璃观察到紫色火焰,则有K离子;检验其中是否含有氯离子,取少量溶液与试管中,加入用硝酸酸化的硝酸银溶液,如果生成白色沉淀,则说明含有氯离子,
答:将固体混合物溶于水配成溶液,取少量溶液与试管中,用洁净的铂丝蘸取溶液在无色火焰上灼烧,若透过蓝色钴玻璃观察到紫色火焰,则有钾离子;再取少量溶液与试管中,加入用硝酸酸化的硝酸银溶液,如果生成白色沉淀,则说明含有氯离子,综合以上分析,可以检验固体Na2SO4中是否可能含KCl.
点评 本题考查氧化还原反应电子转移情况、配平、结构示意图以及离子的检验等,是对元素化合物知识的总运用,难度中等,注意基础知识的掌握.

| A. | ④>③>②>① | B. | ③>①>②>④ | C. | ④>③>①>② | D. | ②>③>④>① |
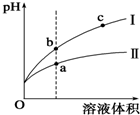 某温度下,相同pH值的盐酸和醋酸溶液分别加水稀释,平衡pH值随溶液体积变化的曲线如图所示.据图判断正确的是( )
某温度下,相同pH值的盐酸和醋酸溶液分别加水稀释,平衡pH值随溶液体积变化的曲线如图所示.据图判断正确的是( )| A. | Ⅱ为盐酸稀释时的pH值变化曲线 | |
| B. | b点酸的总浓度大于a点酸的总浓度 | |
| C. | a点Kw的数值比c点Kw的数值大 | |
| D. | b点溶液的导电性比c点溶液的导电性强 |
| A. | 常温常压下,16克O3中含有的原子数为NA | |
| B. | 标准状况下,22.4L液溴中含有的分子数为NA | |
| C. | 1molH2O中含有的原子个数为NA | |
| D. | 0.1mol/L硫酸铝溶液中含有硫酸根的个数为0.3NA |
| A. | 单质 | B. | 氯化钠 | C. | 氢氧化钠 | D. | 氧化钠 |
[Cu(H2O)4]2+(淡蓝色)+4Cl-?[CuCl4]2-(黄绿色)+4H2O,下列方法能使溶液变成淡蓝色的是( )
| A. | 加压 | B. | 加入NaCl溶液 | C. | 加AgNO3溶液 | D. | 加盐酸 |
| A. | Cu2+、Ba2+、NO3-、Cl- | B. | Mg2+、Na+、CO32-、SO42- | ||
| C. | Fe3+、Ba2+、NO3-、SO42- | D. | Ba2+、Mg2+、NO3-、Cl- |
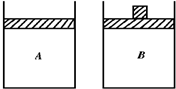 有两只相同的密闭容器A和B,A保持恒容,B保持恒压.起始时向这两只容器中分别充入等量的、物质的量比为4:5的NH3与O2的混合气体,并使A和B容积相等(如图所示),在保持500℃的条件下使之发生4NH3(g)+5O2(g)?4NO(g)+6H2O反应.填写下列空格:
有两只相同的密闭容器A和B,A保持恒容,B保持恒压.起始时向这两只容器中分别充入等量的、物质的量比为4:5的NH3与O2的混合气体,并使A和B容积相等(如图所示),在保持500℃的条件下使之发生4NH3(g)+5O2(g)?4NO(g)+6H2O反应.填写下列空格: