题目内容
6.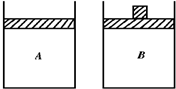 有两只相同的密闭容器A和B,A保持恒容,B保持恒压.起始时向这两只容器中分别充入等量的、物质的量比为4:5的NH3与O2的混合气体,并使A和B容积相等(如图所示),在保持500℃的条件下使之发生4NH3(g)+5O2(g)?4NO(g)+6H2O反应.填写下列空格:
有两只相同的密闭容器A和B,A保持恒容,B保持恒压.起始时向这两只容器中分别充入等量的、物质的量比为4:5的NH3与O2的混合气体,并使A和B容积相等(如图所示),在保持500℃的条件下使之发生4NH3(g)+5O2(g)?4NO(g)+6H2O反应.填写下列空格:(1)确定两容器中的反应速率大小关系,反应刚开始时v(A)=v(B)(填“>”、“=”或“<”下同);建立平衡过程中v(A)>v(B).
(2)两容器中反应达到平衡后NH3的转化率关系:α(A)<α(B)(填“>”、“=”或“<”).
(3)达到平衡后,若向两容器中通入少量且等量的氩气,A容器化学平衡不移动(填“正向移动”、“逆向移动”或“不移动”下同);B容器化学平衡正向移动.
(4)达到平衡后,若向两容器中通入等量的原反应气体,达到新平衡时,A容器中NO的体积分数减小(填“增大”、“减小”或“不变”下同),B容器中NO的体积分数不变.
分析 (1)压强越大反应速率越大,反应刚开始时AB压强相等,随着反应进行,A压强增大,B不变,据此分析;
(2)随着反应进行,A压强增大,B不变,则A相对于B在增大压强,所以平衡向气体体积减小的方向移动,据此分析;
(3)若向两容器中通入少量且等量的氩气,A中体积不变,则反应物生成物浓度不变,B等压,则体积增大,相当于减小压强,平衡向气体体积增大的方向移动,据此判断;
(4)达到平衡后,向两容器中分别通入等量的原反应气体,A容器体积不变,相当于原平衡加压,平衡向逆反应方向移动,B容器由于要恒压,所以容器体积也成比例增大,各物质浓度不变.
解答 解:(1)由于该反应是体积增大的反应,在开始,两容器的体积相同,反应浓度也相同,反应速率相等,在反应过程中,恒压过程中的压强始终小于恒容过程中的,所以A的速率大于B的,故答案为:=;>;
(2)由于该反应是体积减小的反应,恒压过程中的压强始终大于恒容过程中的,而压强大,平衡向逆反应方向移动,所以平衡后NH3的转化率关系:α(A)<α(B),故答案为:<;
(3)达到平衡时,在两容器中分别通入等量的Ar气,A的体积增大,各物质浓度减小,相当于减压,平衡向逆反应方向移动,B中体积不变,所以各物质的浓度不变,所以化学反应速率不变,故答案为:逆;不变;
(4)达到平衡后,向两容器中分别通入等量的原反应气体,A容器体积不变,相当于原平衡加压,平衡向逆反应方向移动,容器中NO的体积分数减小;
B容器由于要恒压,所以容器体积也成比例增大,各物质浓度不变,所以平衡不移动,所以再次达到平衡时,B容器中NO的体积分数不变;
故答案为:减小;不变.
点评 本题主要考查了恒压过程和恒容过程的平衡移动的区别,难度中等,解题时要注意在两种条件下平衡建立的区别.

练习册系列答案
相关题目
14.能在水溶液中大量共存的一组离子是( )
| A. | Ba2+、K+、OH-、SO42- | B. | Fe3+、NO3-、Na+、OH- | ||
| C. | H+、Na+、Cl-、SO42- | D. | K+、SO42-、HCO3-、H+ |
1.下列不能表明醋酸是弱电解质的是( )
| A. | 0.1mol/L的醋酸水溶液中,c(H+)约为10-3mol/L | |
| B. | 常温下同浓度醋酸水溶液的导电性比盐酸弱 | |
| C. | 醋酸水溶液能使紫色石蕊试液变红 | |
| D. | 醋酸稀溶液中同时存在CH3COOH和CH3COO- |
11.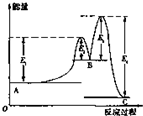 某反应由两步反应A?B?C构成,它的反应能量变化曲线如图所示(E1、E2、E3、E4表示活化能).下列有关叙述正确的是( )
某反应由两步反应A?B?C构成,它的反应能量变化曲线如图所示(E1、E2、E3、E4表示活化能).下列有关叙述正确的是( )
 某反应由两步反应A?B?C构成,它的反应能量变化曲线如图所示(E1、E2、E3、E4表示活化能).下列有关叙述正确的是( )
某反应由两步反应A?B?C构成,它的反应能量变化曲线如图所示(E1、E2、E3、E4表示活化能).下列有关叙述正确的是( )| A. | A→C的反应为吸热反应 | B. | 三种物质中B最不稳定 | ||
| C. | 加入催化剂,E1、E2、E3、E4均不变 | D. | A→C反应的△H=E1-E2 |
16.在无色透明溶液中,能大量共存的离子组是( )
| A. | K+ Cu2+ Na+ SO42- | B. | Mg2+ Cl- OH- SO42- | ||
| C. | K+ H+ NO3- CO32- | D. | Na+ Cl- NO3-CO32- |
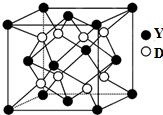 已知A、B、C、D、X、Y是原子序数依次增大的前20号元素,其中A~D的原子序数 是连号的,A的基态原子有3个不同的能级,各能级中的电子数相等;X和Y位于同一主族,
已知A、B、C、D、X、Y是原子序数依次增大的前20号元素,其中A~D的原子序数 是连号的,A的基态原子有3个不同的能级,各能级中的电子数相等;X和Y位于同一主族,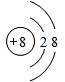 .
.