题目内容
【题目】开发、使用清洁能源发展“低碳经济”,正成为科学家研究的主要课题.氢气、甲醇是优质的清洁燃料,可制作燃料电池. 
(1)已知:①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)△H1=﹣1275.6kJmol﹣1②2CO(g)+O2(g)=2CO2(g)△H2=﹣566.0kJmol﹣1
③H2O(g)=H2O(l)△H3=﹣44.0kJmol﹣1写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:
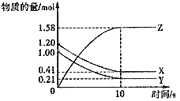
(2)生产甲醇的原料CO和H2来源于:CH4(g)+H2O(g)CO(g)+3H2(g) ①一定条件下CH4的平衡转化率与温度、压强的关系如图a.则,P1P2;A、B、C三点处对应平衡常数(KA、KB、KC)的大小顺序为 . (填“<”、“>”“=”)
②100℃时,将1mol CH4和2mol H2O通入容积为1L 的反应室,反应达平衡的标志是: .
A.容器内气体密度恒定
B.单位时间内消耗0.1mol CH4同时生成0.3mol H2
C.容器的压强恒定
D.3v正(CH4)=v逆(H2)
③如果达到平衡时CH4的转化率为0.5,则100℃时该反应的平衡常数K=
(3)某实验小组利用CO(g)、O2(g)、KOH(aq)设计成如图b所示的电池装置,负极的电极反应式为 . 用该原电池做电源,常温下,用惰性电极电解200mL饱和食盐水(足量),消耗标准状况下的CO 224mL,则溶液的pH= (不考虑溶液体积的变化)
【答案】
(1)CH3OH(l)+O2(g)=CO(g)+2H2O(l)△H=﹣442.8kJ?mol﹣1
(2)<; KC>KB>KA; CD;2.25
(3)CO﹣2e ̄+4OH ̄=CO32 ̄+2H2O;13
【解析】解:(1)①2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(g)△H=﹣1275.6kJmol﹣1
②2CO(g)+O2(g)═2CO2(g)△H=﹣566.0kJmol﹣1
③H2O(g)═H2O(l)△H=﹣44.0kJmol﹣1
根据盖斯定律,将已知反应 ![]() ×(①﹣②+③×4)得到CH3OH(l)+O2(g)=CO(g)+2H2O(l),所以该反应的△H=
×(①﹣②+③×4)得到CH3OH(l)+O2(g)=CO(g)+2H2O(l),所以该反应的△H= ![]() ×[(﹣1275.6kJ/mol)﹣(﹣566.0kJ/mol)+(﹣44.0kJ/mol)×4]=﹣442.8kJmol﹣1,即CH3OH(l)+O2(g)=CO(g)+2H2O(l)△H=﹣442.8kJmol﹣1,
×[(﹣1275.6kJ/mol)﹣(﹣566.0kJ/mol)+(﹣44.0kJ/mol)×4]=﹣442.8kJmol﹣1,即CH3OH(l)+O2(g)=CO(g)+2H2O(l)△H=﹣442.8kJmol﹣1,
所以答案是:CH3OH(l)+O2(g)=CO(g)+2H2O(l)△H=﹣442.8kJmol﹣1;(2)①在图a的200℃位置,平行与纵轴画一条虚线,可见CH4的转化率P1>P2,在CH4(g)+H2O(g)CO(g)+3H2(g)反应中,生成物的气体体积大于反应物,压强增大时平衡向逆向移动,故P1<P2,平衡常数只受温度影响,压强不变升高温度,甲烷的转化率会增大,平衡正向进行,所以反应是吸热反应,温度越高,K越大,A、B、C三点处对应的温度是逐渐升高的,所以平衡常数(KA、KB、KC)的大小顺序为KC>KB>KA,
所以答案是:<;KC>KB>KA;
②A.容器内气体密度= ![]() ,质量是守恒的,V是不变的,所以密度始终不变,当密度不变时,不一定平衡,故A错误;
,质量是守恒的,V是不变的,所以密度始终不变,当密度不变时,不一定平衡,故A错误;
B.单位时间内消耗0.1mol CH4同时生成0.3molH2,只能说明正反应速率,不能证明正逆反应速率相等,不一定平衡,故B错误;
C.反应是前后系数和变化的反应,当容器的压强恒定,则达到了平衡,故C正确;
D.3v正(CH4)=v逆(H2),能体现v(正)=v(逆),故D正确;
所以答案是:CD;
③平衡时甲烷的转化为0.5,则甲烷的浓度变化量=1mol/L×0.5=0.5mol/L,
CH4(g)+ | H2O(g) | CO(g)+ | 3H2(g) | |
起始(mol/L) | 1 | 2 | 0 | 0 |
转化(mol/L) | 0.5 | 0.5 | 0.5 | 1.5 |
平衡(mol/L) | 0.5 | 1.5 | 0.5 | 1.5 |
故平衡常数K= ![]() =2.25,
=2.25,
所以答案是:2.25;(3)电解质溶液呈碱性,则负极上CO失电子和氢氧根离子反应生成碳酸根离子和水,负极反应式为CO﹣2e+4OH=CO32+2H2O,消耗的标准状况下的CO24mL,则CO的物质的量为 ![]() =0.01mol,则转移电子为0.02mol,电解饱和食盐水的离子方程式为:2Cl﹣+2H2O
=0.01mol,则转移电子为0.02mol,电解饱和食盐水的离子方程式为:2Cl﹣+2H2O ![]() H2↑+Cl2↑+2OH﹣,由转移电子守恒可知,生成的氢氧根离子的物质的量为0.02mol,则c(OH﹣)=0.1mol/L,所以pH=13.
H2↑+Cl2↑+2OH﹣,由转移电子守恒可知,生成的氢氧根离子的物质的量为0.02mol,则c(OH﹣)=0.1mol/L,所以pH=13.
所以答案是:CO﹣2e+4OH=CO32+2H2O;13.
【考点精析】解答此题的关键在于理解化学平衡的计算的相关知识,掌握反应物转化率=转化浓度÷起始浓度×100%=转化物质的量÷起始物质的量×100%;产品的产率=实际生成产物的物质的量÷理论上可得到产物的物质的量×100%.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案 目标测试系列答案
目标测试系列答案