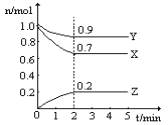
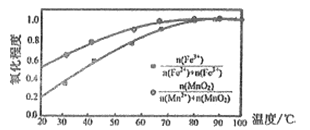
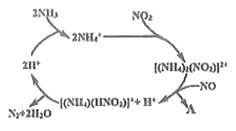
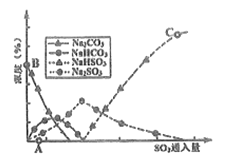
题目内容
【题目】X、Y、Z和W代表原子序数依饮增大的四种短周期元素,X原子核内没有中子,在周期表中,Z与Y、W均相邻; Y、Z和W的原子最外层电子数之和为17。则下列有关叙述正确的是
A. Y、Z和W可能位于同一周期
B. Y和W分别形成的含氧酸均为强酸
C. Y、Z、W分别形成的简单氢化物中,W的简单氢化物相对分子质量最大,熔佛点最高
D. X、Y、Z和W可以组成原子个数比为5: 1:4:1的离子化合物
【答案】D
【解析】分析可知,![]() 为氢元素,设
为氢元素,设![]() 最外层电子为
最外层电子为![]() ,若三者同周期,则有
,若三者同周期,则有![]() ,
,![]() 不存在整数解。
不存在整数解。![]() 与
与![]() 同周期,
同周期,![]() 与
与![]() 同主族,有
同主族,有![]() ,解得
,解得![]() 。因此,
。因此,![]() 为氧元素,
为氧元素,![]() 为氮元素,
为氮元素,![]() 为硫元素。A、氮、氧、硫不在同一周期,故A错误。B、亚硫酸和亚硝酸为弱酸,故B错误。C、虽然
为硫元素。A、氮、氧、硫不在同一周期,故A错误。B、亚硫酸和亚硝酸为弱酸,故B错误。C、虽然![]() 的相对分子质量较高,但由于水中存在分子间氢键,使得水的熔沸点高于
的相对分子质量较高,但由于水中存在分子间氢键,使得水的熔沸点高于![]() ,故C错误。D、
,故C错误。D、![]() 是满足要求的离子化合物,故D正确。本题正确选项为D。
是满足要求的离子化合物,故D正确。本题正确选项为D。

 名校课堂系列答案
名校课堂系列答案【题目】下表是元素周期表的一部分,请回答有关问题:
周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
2 | ① | ② | ③ | |||||
3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
4 | ⑨ | ⑩ |
(1) 表中化学性质最不活泼的元素,其原子结构示意图为________________。
(2) 表中能形成两性氢氧化物的元素是________(填元素名称),写出该元素的单质与⑨最高价氧化物的水化物反应的离方程式____________________________________。
(3) ①、④、⑤、⑥、⑦、⑨六种元素的最高价氧化物的水化物中,按碱性减弱酸性增强的顺序排列为_____________________________________________(用化学式表示)。
(4) ③元素与⑩元素两者核电荷数之差是_____________________________。
(5) 请写出②的氢化物发生催化氧化的化学方程式_______________________________。
(6) 请写出⑤元素的最高价氧化物与⑥元素的最高价氧化物的水化物反应的离子方程式___________________________________。