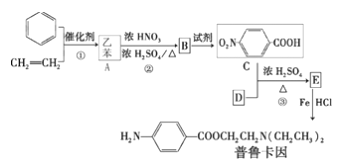
题目内容
【题目】一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如下图所示,下列描述正确的是( )
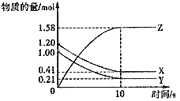
A. 反应开始到10s,用Z表示的反应速率为 0.158moL/(L·s)
B. l0 s后,该反应停止进行
C. 反应的化学方程式为:2X(g)+Y(g)![]() 2Z(g)
2Z(g)
D. 反应开始到l0s时,平均反应速率 :ν(X)=ν(Y)=0.0395mol/(L·s)
【答案】D
【解析】A.反应速率通常用单位时间内浓度的变化量表示;
B.平衡时正逆反应速率相等,不为0;
C.根据图像判断反应物和生成物,结合物质的量的变化量判断;
D.反应速率通常用单位时间内浓度的变化量表示。
A.10s内,用Z表示的反应速率为v(Z)=1.58mol/(2L·10s)=0.079moL/(Ls),A错误;
B.由图可知,l0s后,该反应到达平衡状态,化学平衡状态是动态平衡,v(正)=v(逆)≠0,B错误;
C.由图象可以看出,随反应进行X、Y的物质的量减小,Z的物质的量增大,所以X、Y是反应物,Z是生产物,l0s后X、Y、Z的物质的量为定值,不为0,反应是可逆反应,且△n(X):△n(Y):△n(Z)=(1.20-0.41)mol:(1.00-0.21)mol:1.58mol=1:1:2,参加反应的物质的物质的量之比等于化学计量数之比,故反应化学方程式为X(g)+Y(g)![]() 2Z(g),C错误;
2Z(g),C错误;
D.0~10 s的时间内的平均反应速率:v(X)=v(Y)=0.79mol/(2L·10s)=0.0395 mol·L-1·s-1,D正确;
答案选D。

 字词句段篇系列答案
字词句段篇系列答案【题目】下表是元素周期表的一部分,请回答有关问题:
周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
2 | ① | ② | ③ | |||||
3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
4 | ⑨ | ⑩ |
(1) 表中化学性质最不活泼的元素,其原子结构示意图为________________。
(2) 表中能形成两性氢氧化物的元素是________(填元素名称),写出该元素的单质与⑨最高价氧化物的水化物反应的离方程式____________________________________。
(3) ①、④、⑤、⑥、⑦、⑨六种元素的最高价氧化物的水化物中,按碱性减弱酸性增强的顺序排列为_____________________________________________(用化学式表示)。
(4) ③元素与⑩元素两者核电荷数之差是_____________________________。
(5) 请写出②的氢化物发生催化氧化的化学方程式_______________________________。
(6) 请写出⑤元素的最高价氧化物与⑥元素的最高价氧化物的水化物反应的离子方程式___________________________________。