题目内容
12.除去下列物质中所含的杂质(括号内为杂质),将选用的试剂填在题后的横线上,并写出有关反应的方程式.注:若不需任何试剂,该空填“无”,是离子反应的要求写出离子反应方程式)(1)Na2CO3固体[NaHCO3]加热、2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O.
(2)Fe2O3(Al2O3)加入足量NaOH溶液、过滤、Al2O3+2OH-═2AlO2-+H2O.
(3)FeCl3(FeCl2)通入足量的Cl2、2Fe2++Cl2═2Fe3++2Cl-.
(4)NaHCO3溶液(Na2CO3)通入足量的CO2、CO32-+CO2+H2O=2HCO3-.
(5)Fe(Al)加入过量的NaOH溶液、过滤、2Al+2OH-+2H2O═2AlO2-+3H2↑.
分析 (1)碳酸氢钠加热分解生成碳酸钠;
(2)氧化铝与NaOH反应,而氧化铁不能;
(3)氯气与亚铁离子反应;
(4)碳酸钠、水、二氧化碳反应生成碳酸氢钠;
(5)Al与NaOH溶液反应,而Fe不能.
解答 解:(1)碳酸氢钠加热分解生成碳酸钠,则选择方法为加热,发生的反应为2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O,故答案为:加热;2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O;
(2)氧化铝与NaOH反应,而氧化铁不能,则选择的试剂及方法为加入足量NaOH溶液、过滤,发生的离子反应为Al2O3+2OH-═2AlO2-+H2O,
故答案为:加入足量NaOH溶液、过滤;Al2O3+2OH-═2AlO2-+H2O;
(3)氯气与FeCl2反应生成氯化铁,则选择试剂为通入足量的Cl2,发生的离子反应为2Fe2++Cl2═2Fe3++2Cl-,
故答案为:通入足量的Cl2;2Fe2++Cl2═2Fe3++2Cl-;
(4)碳酸钠、水、二氧化碳反应生成碳酸氢钠,则选择试剂为通入足量的CO2,离子反应为CO32-+CO2+H2O=2HCO3-,
故答案为:通入足量的CO2;CO32-+CO2+H2O=2HCO3-;
(5)Al与NaOH溶液反应,而Fe不能,则选择试剂和方法为加入过量的NaOH溶液,过滤,发生的离子反应为2Al+2OH-+2H2O═2AlO2-+3H2↑,
故答案为:加入过量的NaOH溶液、过滤;2Al+2OH-+2H2O═2AlO2-+3H2↑.
点评 本题考查物质分离提纯方法和选择及金属及化合物的性质,为高频考点,把握物质的性质及性质差异为解答的关键,注意除杂不能引入新杂质,题目难度不大.

| A. | 氧气过量 | B. | 使用催化剂 | C. | 400℃~500℃的高温 | D. | 常压 |
| A. | Na+,Ca2+,HCO3-,OH- | B. | K+,NH4+,S2-,OH- | ||
| C. | Mg2+,K+,HSO3-,H+ | D. | K+,Na+,NO3-,CO32- |
| A. | c(OH-)=2×10-7mol/L | B. | c(OH-)=5×10-8mol/L | ||
| C. | 无法确定OH-浓度 | D. | 该温度低于室温 |
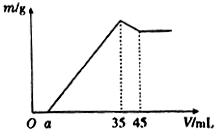 准确称取6g铝土矿样品(含Al2O3、Fe2O3、SiO2)放入盛有100mL某浓度硫酸溶液的烧杯中,充分反应后过滤,向滤液中加入10mol•L-l的NaoH溶液,产生的沉淀质量m与加入的NaOH溶液的体积V的关系如图所示,则所用硫酸溶液的物质的量浓度为( )
准确称取6g铝土矿样品(含Al2O3、Fe2O3、SiO2)放入盛有100mL某浓度硫酸溶液的烧杯中,充分反应后过滤,向滤液中加入10mol•L-l的NaoH溶液,产生的沉淀质量m与加入的NaOH溶液的体积V的关系如图所示,则所用硫酸溶液的物质的量浓度为( )| A. | 3.50mol/L | B. | 1.75mol/L | C. | 0.85mol/L | D. | 无法计算 |
