题目内容
【题目】高氯酸钠可用于制备高氯酸。以精制盐水等为原料制备高氯酸钠晶体(NaClO4·H2O)的流程如图:
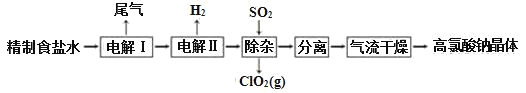
(1)为有效除去Ca2+、Mg2+、SO42-,加入试剂的合理顺序为______。
A.先加NaOH,后加Na2CO3,再加钡试剂
B.先加NaOH,后加钡试剂,再加Na2CO3
C.先加钡试剂,后加NaOH,再加Na2CO3
除去盐水中的Br-可以节省电解过程中的电能,其原因是_____。
(2)“电解Ⅰ”的目的是制备NaClO3溶液,产生的尾气除H2外,还含有_____(填化学式)。“电解Ⅱ”的化学方程式为____。
(3)“除杂”的目的是除去少量的未反应的NaClO3杂质,该反应的离子方程式为_____。“气流干燥”时,温度控制在80~100℃,温度不能过高的原因是_____。
【答案】BC 电解时Br-被氧化 Cl2 NaClO3+H2O![]() NaClO4+H2↑ 2ClO3-+SO2=2ClO2+SO42- 温度太高,高氯酸钠晶体失去结晶水或分解
NaClO4+H2↑ 2ClO3-+SO2=2ClO2+SO42- 温度太高,高氯酸钠晶体失去结晶水或分解
【解析】
由原料氯化钠到高氯酸钠晶体,氯的化合价升高,而整个流程中未加强氧化剂,所以通过电解实现了氯的不同价态的转化(电解过程即为氧化还原反应),将制得的盐水一次电解产生氯酸钠,得到的氯酸钠溶液进行再一次电解,生成高氯酸钠,然后通入二氧化硫除去其中的氯酸钠,最后进行分离提纯得到高氯酸钠晶体。
(1)NaOH可以除去Mg2+,钡试剂可以除去硫酸根,碳酸钠可以除去钙离子同时可以除去过量的钡离子,所以碳酸钠要在钡试剂之后加入,所以添加的试剂顺序为:先加NaOH,后加钡试剂,再加Na2CO3或先加钡试剂,后加NaOH,再加Na2CO3,所以选BC;Br-的还原性强于氯离子,所以电解过程中溴离子优先被氧化,消耗更多的电能;
(2)电解过程中阳极氯离子放电,主要生成氯酸根离子,也有部分产生氯气,而阴极氢离子放电,生成氢气,所以尾气有氢气和少量的氯气;电解Ⅱ氯酸根离子在阳极放电生成高氯酸根,而阴极是水电离产生的氢离子放电,生成氢气,所以电解反应方程式为:NaClO3+H2O![]() NaClO4+H2↑;
NaClO4+H2↑;
(3)由图示可知通入二氧化硫除去其中的氯酸根离子,Cl(+5→+4),S(+4→+6),根据得失电子守恒和电荷守恒,该反应的离子方程式为:2ClO3-+SO2=2ClO2+SO42-;温度太高晶体可能失水,同时温度太高可能使高氯酸钠分解。