题目内容
某二元酸(简写为H2A)溶液,按下式电离: H2A=H++HA- HA-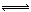 H++A2-,已知常温下浓度为0.1mol/L的H2A溶液中c(H+)=0.11mol/L,则关于0.1mol/L的NaHA溶液的下列叙述中正确的是:( )
H++A2-,已知常温下浓度为0.1mol/L的H2A溶液中c(H+)=0.11mol/L,则关于0.1mol/L的NaHA溶液的下列叙述中正确的是:( )
A.溶液肯定不显中性,但显酸性还是碱性无法确定
B.常温下0.1mol/L的NaHA溶液的PH=2
C.溶液中c(Na+)=c(HA-)+ c(A2-)
D.溶液中c(Na+)>c(HA-)>c(A2-)>c(H+)
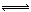 H++A2-,已知常温下浓度为0.1mol/L的H2A溶液中c(H+)=0.11mol/L,则关于0.1mol/L的NaHA溶液的下列叙述中正确的是:( )
H++A2-,已知常温下浓度为0.1mol/L的H2A溶液中c(H+)=0.11mol/L,则关于0.1mol/L的NaHA溶液的下列叙述中正确的是:( )A.溶液肯定不显中性,但显酸性还是碱性无法确定
B.常温下0.1mol/L的NaHA溶液的PH=2
C.溶液中c(Na+)=c(HA-)+ c(A2-)
D.溶液中c(Na+)>c(HA-)>c(A2-)>c(H+)
C
由电离方程式可以知道H2A的一级电离为强电离,二级电离为弱电离,所以HA-不发生水解,只发生电离,电离显酸性所以NaHA溶液显酸性,A错误;由于HA-的电离是弱电离所以无法计算常温下0.1mol/L的NaHA溶液中的氢离子浓度,无法确定PH的具体值,B错误;根据NaHA溶液中的元素守恒可以知道钠元素与A元素的浓度之比为1:1,所以c(Na+)=c(HA-)+ c(A2-),C正确;NaHA溶液中,HA-电离出的H+和A2-浓度相等,但是考虑水电离出H+所以c(H+)>c(A2-),D错误;答案选C。

练习册系列答案
相关题目

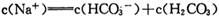
 HCO3—+OH—平衡。下列说法不正确的是
HCO3—+OH—平衡。下列说法不正确的是 增大
增大 ,溶液pH减小
,溶液pH减小 减小
减小
