��Ŀ����
����Ŀ����þһ��������ȼ�ϵ������Դģ��������ҵ���Է�ˮ�е�Cr2O72-�Ĺ���(����Cr2O72-����ԭΪ��Cr3+��)��װ����ͼ��ʾ������˵���д������
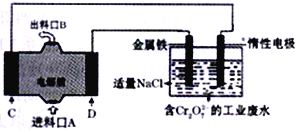
A. �������缫�ķ�ӦΪ:Fe-2e-=Fe2+
B. װ���е��ӵ�����·����: C�缫�����Ե缫���������缫��D�缫
C. װ�ù�������������14.4gMg�������Ͽ�����Cr2O72-0.1mol
D. ��Cr2O72-������ķ�ˮ��ԭ��ҵ��ˮ��pH����
���𰸡�B
��������Fe2+��Cr2O72-��ԭΪCr3+��������������Fe2+���������缫�ķ�ӦΪ:Fe-2e-=Fe2+����A��ȷ���������Һ��û�е�������������װ���е��ӵ�����·����: C�缫�����Ե缫���������缫��D�缫����B����װ�ù�������������14.4gMg��ת�Ƶ���1.2mol����������Fe2+0.6mol������Cr2O72+6Fe2++14H+�T2Cr3++6Fe3++7H2O��0.6mol Fe2+������Cr2O72-0.1mol����C��ȷ�����������ӵõ�����������������������Cr2O72+6Fe2++14H+�T2Cr3++6Fe3++7H2O�����Խ�Cr2O72-������ķ�ˮ��ԭ��ҵ��ˮ��pH��������D��ȷ��

��ϰ��ϵ�д�
�����Ŀ