��Ŀ����
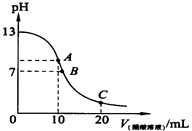
����Ŀ����֪ˮ��25���95��ʱ������ƽ��������ͼ��ʾ�� 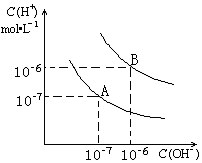
��1����25��ʱˮ�ĵ���ƽ������ӦΪ���A����B��������˵������
��2��25��ʱ����pH=9��NaOH��Һ��pH=4��H2SO4��Һ��ϣ������û����Һ�� pH=7����NaOH��Һ��H2SO4��Һ�������Ϊ
��3��95��ʱ����100���pH1=a��ijǿ����Һ��1���pH2=b��ijǿ����Һ��Ϻ���Һ�����ԣ�����ǰ����ǿ���pH1��ǿ���pH2֮��Ӧ����Ĺ�ϵ��
��4������B��Ӧ�¶��£�pH=2��ijHA��Һ��pH=10��NaOH��Һ�������Ϻ����Һ��pH=5���������ԭ�� ��
���𰸡�
��1��A��ˮ�ĵ���ʱ���ȹ���,���ȴٽ�����,�¶ȵ�,ˮ�����ӻ�С
��2��10��1
��3��pH1+pH2=14,��a+b=14
��4������B��Ӧ95��,��ʱˮ�����ӻ�Ϊ10��12,HAΪ����,HA�к�NaOH��,�����Һ�л�ʣ��϶��HA����,�ɼ��������H+,ʹ��ҺpH=5
���������⣺��1������A������Kw=c��H+����c��OH����=10��7��10��7=10��14������B������c��H+��=c��OH����=10��6 mol/L��Kw=c��H+��c��OH����=10��12 ��ˮ�ĵ���ʱ���ȹ��̣����ȴٽ����룬����A���ߴ���25��ʱˮ�ĵ���ƽ�����ߣ�
�ʴ�Ϊ��A��ˮ�ĵ���ʱ���ȹ��̣����ȴٽ����룬�¶ȵͣ�ˮ�����ӻ�С����2��25��ʱ���û����Һ��pH=7����Һ�����Լ����ǡ���кͣ���n��OH����=n��H+������V��NaOH��10��5 molL��1=V��H2SO4��10��4 molL��1����V��NaOH����V��H2SO4��=10��1���ʴ�Ϊ��10��1����3��Ҫע�����95��Cʱ��ˮ�����ӻ�Ϊ10��12�����ᡢ��Ũ�����ʱpH���ᣩ+pH���=12����ǿ���OH��Ũ����ǿ��H+Ũ�ȵ�100��������pH���ᣩ+pH���=14����pH1+pH2=14����a+b=14���ʴ�Ϊ��pH1+pH2=14����a+b=14����4��������B��Ӧ�¶��£���pH���ᣩ+pH���=12���ɵ��������Һ��c��H+��=c��OH����������ǿ������Һ�������Ϻ���Һ�����ԣ��ֻ����Һ��pH=5�����������Ϻ���Һ�����ԣ�˵��H+��OH����ȫ��Ӧ�������µ�H+�������������������HA�����ᣬ
�ʴ�Ϊ������B��Ӧ95�棬��ʱˮ�����ӻ�Ϊ10��12��HAΪ���ᣬHA�к�NaOH�����Һ�л�ʣ��϶��HA���ӣ��ɼ��������H+��ʹ��ҺpH=5��
��1��������������Ũ�ȣ�����������������Ũ�ȣ�ˮ�����ӻ�����Kw=c��H+����c��OH���������A���ߵ�Kwֵ���ˮ�ĵ���ʱ���ȱȽ��ж�25��ʱˮ�ĵ���ƽ�����ߣ���2��������Һ��pH�������Һ�������ӡ�����������Ũ�ȣ�����ʽ���������������Һ��������Һ���������3���ᡢ���ǿ����ʣ���Һ������˵�������Ӻ����������ӵ����ʵ�����ȣ����ˮ�����ӻ�����ȷ��ǿ���pH1��ǿ���pH2֮��Ӧ����Ĺ�ϵ����4����������B��Ӧ�¶���pH=5��˵����Һ��ʾ���ԣ���Ӧ�������ӹ���������

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�