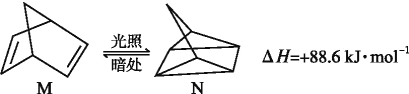
��Ŀ����
����Ŀ������������ȷ���ǣ�������
A.��ϡ��ˮ��μ���ϡ�����У�����Һ��pH=7ʱ��c��SO42������c��NH4+��
B.NaHCO3��Һ�У�c ��CO32����+c��H+��=c��H2CO3��+c��OH����
C.1 L 0��1 molL��1CuSO4��NH4��2SO46H2O��Һ�У�c��SO42������c��NH4+����c��Cu2+����c��H+����c��OH����
D.��0.1mol/L�İ�ˮ�м�����������粒��壬����Һ��c��OH����/c��NH3H2O������
���𰸡�C
���������⣺A�������Һ�����ԣ���c��H+��=c��OH���������ݵ���غ�c��NH4+��+c��H+��=c��OH����+2c��SO42������֪��2c��NH4+��=c��SO42��������c��NH4+����c��SO42��������A����
B������NaHCO3��Һ�е������غ�ɵã�c��H2CO3��+c��H+��=c��OH����+c ��CO32��������B����
C��1 L 0��1 molL��1CuSO4��NH4��2SO46H2O��Һ�У�笠����Ӳ���ˮ�⣬��c��SO42������c��NH4+����ˮ��̶Ƚ�С����c��NH4+����c��Cu2+������Һ������Ũ�ȴ�СΪ��c��SO42������c��NH4+����c��Cu2+����c��H+����c��OH��������C��ȷ��
D����0.1mol/L�İ�ˮ�м�����������粒��壬��Һ��笠�����Ũ��������һˮ�ϰ��ĵ���ƽ�ⳣ����֪��c��OH����/c��NH3H2O��= ![]() ����c��OH����/c��NH3H2O���ı�ֵ��С����D����
����c��OH����/c��NH3H2O���ı�ֵ��С����D����
��ѡC��