题目内容
【题目】在 Cu/ZnO催化剂存在下,CO2和H2可发生下列反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)
(1)反应中被氧化的元素是:____,氧化剂是____。试在下列方程式中用单线桥标出电子转移的方向和数目:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)____
CH3OH(g)+H2O(g)____
(2)该反应的平衡常数表达式 K=____。若只增加CO2的浓度,该平衡向____移动,平衡常数 K___(选填“增大”、“小”或“不变”)。
(3)从下图可以看出,由于温度不同,A和B中___先达到平衡状态,说明反应温度 A___B(选填“>”、“<”或“=”),从甲醇体积分数的比较还可以说明该反应是______热反应(选填“放”或“吸”);反应进行到图中M处时,正反应速率______逆反应速率(选填“>”、 “<”或“=”)。

(4)一定条件下,将 n(CO2):n(H2)=1:1 的混合气充入恒温恒容密闭容器中,若容器中气体______(选填“密度”或“压强”)保持不变,说明该反应已达平衡状态。
【答案】 H CO2 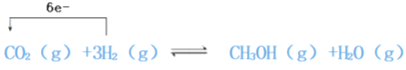
![]() 正反应方向 不变 B < 放 > 压强
正反应方向 不变 B < 放 > 压强
【解析】(1)反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)中氢气中氢元素由0价变为+1价,被氧化;故被氧化的元素为H元素;二氧化碳中碳由+4价变为-2价,转移电子数为6,氧化剂是CO2;用单线桥标出电子转移的方向和数目为:
CH3OH(g)+H2O(g)中氢气中氢元素由0价变为+1价,被氧化;故被氧化的元素为H元素;二氧化碳中碳由+4价变为-2价,转移电子数为6,氧化剂是CO2;用单线桥标出电子转移的方向和数目为: ;(2)反应CO2(g)+3H2(g)
;(2)反应CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)的平衡常数表达式 K=
CH3OH(g)+H2O(g)的平衡常数表达式 K=![]() ;若只增加 CO2的浓度,该平衡向正反应方向移动,平衡常数只与温度有关,反应温度不变,故平衡常数 K不变;(3)从右图可以看出,由于温度不同,根据先拐先平,A 和 B 中B先达到平衡状态,说明反应温度 A<B,温度高甲醇的体积分数小,说明升高温度平衡向逆反应方向移动,则该反应是放热反应;反应进行到图中 M 处时还没达到平衡状态,反应向正方向进行,故正反应速率>逆反应速率。(4)一定条件下,将 n(CO2):n(H2)=1:1 的混合气充入恒温恒容密闭容器中,恒容条件下反应物均为气体时密度始终保持不变,密度不变不能说明反应达平衡,故若容器中气体压强保持不变,说明该反应已达平衡状态。
;若只增加 CO2的浓度,该平衡向正反应方向移动,平衡常数只与温度有关,反应温度不变,故平衡常数 K不变;(3)从右图可以看出,由于温度不同,根据先拐先平,A 和 B 中B先达到平衡状态,说明反应温度 A<B,温度高甲醇的体积分数小,说明升高温度平衡向逆反应方向移动,则该反应是放热反应;反应进行到图中 M 处时还没达到平衡状态,反应向正方向进行,故正反应速率>逆反应速率。(4)一定条件下,将 n(CO2):n(H2)=1:1 的混合气充入恒温恒容密闭容器中,恒容条件下反应物均为气体时密度始终保持不变,密度不变不能说明反应达平衡,故若容器中气体压强保持不变,说明该反应已达平衡状态。

【题目】温度700℃时,向容积为1L的密闭容器中充入一定量的CO和H2O发生反应CO(g)+H2O(g)CO2(g)+H2(g),反应过程中测定的部分数据见表(表中t1<t2).下列说法正确的是( )
反应时间/min | n(CO)/mol | n(H2O)/mol |
0 | 0.60 | 0.30 |
t1 | 0.40 | |
t2 | 0.10 |
A.反应在t1min内的平均速率为v(H2)=0.20/t1molL﹣1min﹣1
B.保持其他条件不变,向平衡体系中再通入0.10molH2O,与原平衡相比,达到新平衡时CO转化率增大,H2O的体积分数减小
C.温度升至800℃,上述反应平衡常数为0.64,则正反应为吸热反应
D.700℃时,若向密闭容器中充入CO(g)、H2O(g)、CO2(g)、H2(g)的物质的量分别为0.60mol、1.00mol、0.60mol、0.60mol,则此时该反应v(正)<v(逆)