题目内容
12. 加热碳酸铵[(NH4)2CO3】并使产物全部变成气态.
加热碳酸铵[(NH4)2CO3】并使产物全部变成气态.(1)若将生成的混合气体依次通过足量的Na2O2和浓H2SO4,测得Na2O2增重m1g,浓H2SO4增重n1g
若将生成的混合气体依次通过足量的浓H2SO4和Na2O2,测得浓H2SO4增重n2g,Na2O2增重m2g.(设有关气体全部被吸收)则m1>m2(填“>”、“<”或“=”,下同)n1<n2
(2)在100ml NaOH溶液中加入(NH4)2CO3和(NH4)2SO4的固体混合物,加热充分反应.如图表示加入的混合物质量和产生的气体体积(标准状况)的关系.
试计算:
①NaOH溶液的物质的量浓度5mol/L
②当NaOH溶液的体积为140mL,固体混合物质量是51.6g时,充分反应后,生成气体的体积为15.68L
③当NaOH溶液体积为180mL时,固体混合物的质量为51.6g时,充分反应后,生成气体的体积为16.8L.
分析 (1)碳酸氢铵受热分解为氨气、水以及二氧化碳,水和二氧化碳均可以和过氧化钠发生反应生成盐和氧气,浓硫酸可以和氨气发生反应,据此回答;
(2)①氢氧化钠与NH4NO3和(NH4)2SO4的混合物生成氨气,发生反应NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+2H2O,由图象可知,加入固体34.4g时生成氨气体积增大为11.2L,根据n=$\frac{V}{Vm}$氨气的物质的量,结合方程式计算氢氧根的物质的量,再根据c=$\frac{n}{V}$计算氢氧化钠的物质的量浓度;
②当固体混合物的质量是51.6 g时,固体混合物完全反应消耗的氢氧化钠溶液的体积为:$\frac{51.6g}{34.4g}$×100ml=150ml,而V(NaOH)=140 mL,说明固体过量,故n(NH3)=n(NaOH),据此计算解答;
③由(2)分析可知,当V(NaOH)=180 mL时,说明NaOH过量,则固体51.6 g完全反应,再根据固体质量与生成气体体积关系计算.
解答 解:(1)碳酸氢铵受热分解为氨气、水以及二氧化碳,水和二氧化碳均可以和过氧化钠发生反应生成盐和氧气,浓硫酸可以和氨气发生反应,若将生成的混合气体依次通过足量的Na2O2和浓H2SO4,测得Na2O2增重m1g,此时过氧化钠吸收的是水以及二氧化碳,浓H2SO4增重n1g,此时浓硫酸吸收的只有氨气,若将生成的混合气体依次通过足量的浓H2SO4和Na2O2,测得浓H2SO4增重n2g,此时浓硫酸吸收的有氨气和水,Na2O2增重m2g,此时过氧化钠吸收的只有二氧化碳,所以n2>n1,m1>m2,
故答案为:>;<;
(2)①氢氧化钠与NH4NO3和(NH4)2SO4的混合物生成氨气,发生反应NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+2H2O,从图中可看出34.4 g混合物和100 mL NaOH恰好完全反应.则n(NaOH)=n(NH3)=$\frac{11.2L}{22.4L/mol}$=0.5 mol,c(NaOH)=$\frac{0.5mol}{0.1L}$=5mol/L,
故答案为:5mol/L;
②当固体混合物的质量是51.6 g时,固体混合物完全反应消耗的氢氧化钠溶液的体积为:$\frac{51.6g}{34.4g}$×100ml=150ml,而V(NaOH)=140 mL,说明固体过量,所以n(NH3)=n(NaOH)=5 mol/L×0.14 L=0.7mol,V(NH3)=0.7mol×22.4 L/mol=15.68 L,
故答案为:15.68;
③由(2)分析可知,当V(NaOH)=180 mL时,说明NaOH过量,则固体51.6 g完全反应,故V(NH3)=11.2L×$\frac{51.6g}{34.4g}$×100ml=16.8 L,故答案为:16.8.
点评 本题以图象形式,考查混合物的有关计算,注意发生反应的本质,利用离子方程式进行解答,综合考查学生分析解决问题的能力,难度中等.

 阅读快车系列答案
阅读快车系列答案①Cl2+2KBr═2KCl+Br2,②KClO3+6HCl═3Cl2+KCl+3H2O,③2KBrO3+Cl2═Br2+2KClO3,
下列说法正确的是.
| A. | 上述三个反应都有单质生成,所以都是置换反应 | |
| B. | 氧化性由强到弱顺序为 KBrO3>KClO3>Cl2>Br2 | |
| C. | 反应②中还原剂与氧化剂的物质的量之比为6:1 | |
| D. | ③中lmol还原剂反应则氧化剂得到电子的物质的量为2mol |
| 选项 | A | B | C | D |
| 装置 | 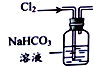 | 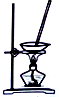 | 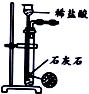 | 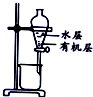 |
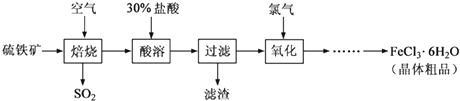
| 目的 | 除去Cl2中含有的少量HCl | 蒸发NaCl饱和溶液制备NaCl晶体 | 制取少量纯净的CO2气体 | 分离酒精和水的混合溶液 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 离子化合物中都含有离子键 | |
| B. | 离子化合物中的阳离子只能是金属离子 | |
| C. | 有些离子化合物可能含有共价键 | |
| D. | 溶于水可以导电的化合物一定是离子化合物 |
| A. | Ba(OH)2溶液中滴加稀硫酸:Ba2++2OH-+2H++SO42-═BaSO4↓+2H2O | |
| B. | 将少量铜屑放入浓硝酸中:Cu+4H++2NO3-═Cu2++2NO2↑+2H2O | |
| C. | 过量的二氧化碳通入“水玻璃”中:CO2+SiO32-+H2O═CO32-+H2SiO3↓ | |
| D. | Cl2通入NaOH稀溶液中:Cl2+2OH-═Cl-+ClO-+H2O |
| A. | 在放电时,正极发生的反应是Pb(s)+SO42-(ag)-2e-═PbSO4(s) | |
| B. | 在充电时,电池中硫酸的浓度不断变小 | |
| C. | 在充电时,阴极发生的反应是PbSO4(s)+2e-═Pb(s)+SO42-(ag) | |
| D. | 在放电时,该电池的负极材料是氧化铅 |
| A. | 氨水能跟H2SO4反应生成(NH4)2SO4 | B. | 铵盐受热易分解 | ||
| C. | 0.1mol/L的氨水可使酚酞试液变红 | D. | 25℃,0.1mol/L氨水的pH约为12 |