题目内容
2.下列事实可能证明一水合氨是弱碱的是( )| A. | 氨水能跟H2SO4反应生成(NH4)2SO4 | B. | 铵盐受热易分解 | ||
| C. | 0.1mol/L的氨水可使酚酞试液变红 | D. | 25℃,0.1mol/L氨水的pH约为12 |
分析 溶液中存在电解质分子与电解质离子之间的平衡,说明电解质属于弱电解质,
A.强碱、弱碱都能与硫酸发生中和反应;
B.铵盐受热易分解,说明铵盐不稳定,与氨水呈碱性及强弱无关
C.酚酞试液变红,说明溶液呈碱性,不能说明具体的pH值;
D.若为强碱溶液,0.1mol/L氨水溶液的pH为13.
解答 解:A.氨水能跟H2SO4反应生成(NH4)2SO4,说明氨水呈碱性,不能说明氨水是弱碱,故A错误;
B.铵盐受热易分解,说明铵盐不稳定,与氨水呈碱性及强弱无关,故B错误;
C.0.1mol/L氨水可以使酚酞试液变红,说明氨水呈碱性,不能说明氨水是弱碱,故C错误;
D.室温下,0.1mol/L氨水溶液的pH约为12,说明一水合氨没有完全电离,所以它为弱碱,故D正确;
故选D.
点评 本题考察强弱电解质的判断,难度不大,注意强弱电解质的本质在于电解质是否完全电离.

练习册系列答案
 仁爱英语同步练习册系列答案
仁爱英语同步练习册系列答案 学习实践园地系列答案
学习实践园地系列答案
相关题目
13.下列说法一定正确的是( )
| A. | 其他条件不变时,增大反应的物质的量,反应速率增大,化学平衡发生移动 | |
| B. | 其他条件不变时,升高温度,化学平衡向放热反应的方向移动 | |
| C. | 其他条件不变时,增大压强,化学反应速率增大,化学平衡发生移动 | |
| D. | 其他条件不变时,使用催化剂,化学反应速率改变,化学平衡不移动 |
17.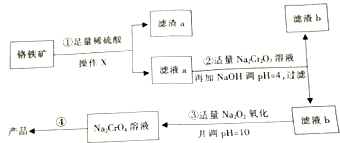 以铬铁矿(主要成分FeO•Cr2O3,含有少量SiO2等)为原料制取铬酸钠晶体(Na2CrO4)工艺流程如图所示.
以铬铁矿(主要成分FeO•Cr2O3,含有少量SiO2等)为原料制取铬酸钠晶体(Na2CrO4)工艺流程如图所示.
已知:①酸性溶液中Cr的+6价易被还原为+3价;当pH>9时Cr以CrO2-形式存在且易被氧化;
②常温下,部分阳离子以氢氧化物形式沉淀时溶液的pH如下:
(1)滤渣a的主要成分的化学式是SiO2;操作X用到的玻璃仪器有烧杯、玻璃棒、和漏斗.
(2)第④步得到产品涉及到的操作有蒸发浓缩、降温结晶、过滤、洗涤等.
(3)第①步反应的离子方程式是FeO+2H+=Fe2++H2O、Cr2O3+6H+=2Cr3++3H2O,第②步产生滤渣b的原因是Fe3+水解生成氢氧化铁沉淀.
(4)已知:1molAl完全燃烧放热a KJ,1mol Fe完全燃烧生成Fe3O4放热b KJ,写出Al与Fe3O4发生铝热反应的热化学方程式8Al(s)+3Fe3O4 (s)=9Fe(s)+4Al2O3 (s),△H=(8a-9b)kJ/mol.
(5)若现有224kg铬铁矿(其中含FeO•Cr2O3 50%),按上述流程最多可以得到Na2CrO4产品的质量是189kg(假设每步均恰好完全转化).
 以铬铁矿(主要成分FeO•Cr2O3,含有少量SiO2等)为原料制取铬酸钠晶体(Na2CrO4)工艺流程如图所示.
以铬铁矿(主要成分FeO•Cr2O3,含有少量SiO2等)为原料制取铬酸钠晶体(Na2CrO4)工艺流程如图所示.已知:①酸性溶液中Cr的+6价易被还原为+3价;当pH>9时Cr以CrO2-形式存在且易被氧化;
②常温下,部分阳离子以氢氧化物形式沉淀时溶液的pH如下:
| 阳离子 | Fe3+ | Fe2+ | Cr3+ |
| 开始沉淀时的pH | 2.7 | 7.6 | |
| 沉淀完全的pH | 3.7 | 9.6 | 9(>9)溶解 |
(2)第④步得到产品涉及到的操作有蒸发浓缩、降温结晶、过滤、洗涤等.
(3)第①步反应的离子方程式是FeO+2H+=Fe2++H2O、Cr2O3+6H+=2Cr3++3H2O,第②步产生滤渣b的原因是Fe3+水解生成氢氧化铁沉淀.
(4)已知:1molAl完全燃烧放热a KJ,1mol Fe完全燃烧生成Fe3O4放热b KJ,写出Al与Fe3O4发生铝热反应的热化学方程式8Al(s)+3Fe3O4 (s)=9Fe(s)+4Al2O3 (s),△H=(8a-9b)kJ/mol.
(5)若现有224kg铬铁矿(其中含FeO•Cr2O3 50%),按上述流程最多可以得到Na2CrO4产品的质量是189kg(假设每步均恰好完全转化).
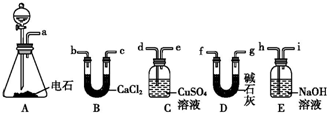
14.图为元素周期表的一部分,请参照元素①~⑧在表中的位置,用化学用语回答下列问题:
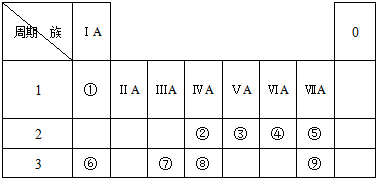
(1)②是C.
(2)9种元素中非金属性最强的是F.
(3)④⑥⑦的原子半径由小到大的顺序为O<Al<Na.
(4)②③⑧的最高价含氧酸的酸性由弱到强的顺序是H2SiO3<H2CO3<HNO3.
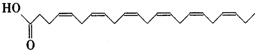
(5)由以上某些元素组成的有机化合物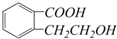 ,其分子式是C9H10O3,含氧官能团的名称是:羧基、醇羟基.
,其分子式是C9H10O3,含氧官能团的名称是:羧基、醇羟基.
(6)某化学兴趣小组为探究⑨单质、Br2、Fe3+的氧化性强弱,设计了如下实验: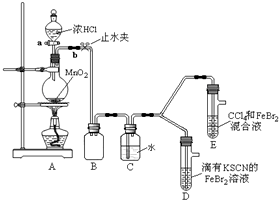
①整套实验装置存在一处明显的不足,请指出缺少尾气处理装置.
②用改正后的装置进行实验,实验过程如下:

(1)②是C.
(2)9种元素中非金属性最强的是F.
(3)④⑥⑦的原子半径由小到大的顺序为O<Al<Na.
(4)②③⑧的最高价含氧酸的酸性由弱到强的顺序是H2SiO3<H2CO3<HNO3.
(5)由以上某些元素组成的有机化合物
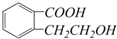 ,其分子式是C9H10O3,含氧官能团的名称是:羧基、醇羟基.
,其分子式是C9H10O3,含氧官能团的名称是:羧基、醇羟基.(6)某化学兴趣小组为探究⑨单质、Br2、Fe3+的氧化性强弱,设计了如下实验:

①整套实验装置存在一处明显的不足,请指出缺少尾气处理装置.
②用改正后的装置进行实验,实验过程如下:
| 实验操作 | 实验现象 | 结论 |
| 打开活塞a,向圆底烧瓶中滴入适量浓盐酸;然后关闭活塞a,点燃酒精灯. | D装置中:溶液变红 E装置中:水层溶液变黄,振荡后,CCl4层无明显变化,持续通入一段时间后,CCl4层变为棕色 | ⑨单质、Br2、Fe3+的氧化性由强到弱的顺序是: ⑨单质(或Cl2)>Br2>Fe3+ |
 加热碳酸铵[(NH4)2CO3】并使产物全部变成气态.
加热碳酸铵[(NH4)2CO3】并使产物全部变成气态.