题目内容
2.氧化还原反应中,氧化剂的氧化性大于氧化产物的氧化性;还原剂的还原性大于还原产物的还原性.现有以下反应( )①Cl2+2KBr═2KCl+Br2,②KClO3+6HCl═3Cl2+KCl+3H2O,③2KBrO3+Cl2═Br2+2KClO3,
下列说法正确的是.
| A. | 上述三个反应都有单质生成,所以都是置换反应 | |
| B. | 氧化性由强到弱顺序为 KBrO3>KClO3>Cl2>Br2 | |
| C. | 反应②中还原剂与氧化剂的物质的量之比为6:1 | |
| D. | ③中lmol还原剂反应则氧化剂得到电子的物质的量为2mol |
分析 A.置换反应中不仅有单质生成还必须有单质参加;
B.根据同一化学反应中,氧化剂的氧化性大于氧化产物的氧化性来判断氧化性强弱;
C.根据氯气和转移电子之间的关系式计算;
D.根据元素化合价变化计算.
解答 解:A、根据置换反应的概念分析,反应②中生成物有单质生成但反应物没有单质参加,不是置换反应,故A错误;
B、反应①中氧化剂是氯气,氧化产物是溴,所以氯气的氧化性大于溴,反应②中氧化剂是氯酸钾,氧化产物是氯气,氯酸钾的氧化性大于氯气,反应③中氧化剂是溴酸钾,氧化产物是氯酸钾,所以溴酸钾的氧化性大于氯酸钾,总之,氧化性强弱顺序是 KBrO3>KClO3>Cl2>Br2,故B正确;
C、反应②KClO3+6HCl=3Cl2+KCl+3H2O中,氧化剂是氯酸钾,还原剂是参加反应氯化氢的5/6,所以还原剂和氧化剂的物质的量之比是5:1,故C错误;
D、反应③中还原剂是氯气,氧化剂是溴酸钾,该反应式中lmol还原剂反应则氧化剂得到电子的物质的量10mol,故D错误.
故选B.
点评 本题考查了氧化还原反应,明确元素化合价是解本题的关键,易错选项是C,注意该选项中不是所有氯化氢都参加氧化还原反应,为易错点,题目难度不大.

练习册系列答案
 口算小状元口算速算天天练系列答案
口算小状元口算速算天天练系列答案
相关题目
10.下列各溶液中,微粒的物质的量浓度关系正确的是( )
| A. | Na2CO3溶液中:2c(Na+)═c(CO32-)+c(HCO3-)+c(H2CO3) | |
| B. | 0.1 mol/L Na2CO3溶液:c(OH-)═c(HCO3-)+c(H+)+2c(H2CO3) | |
| C. | 向醋酸钠溶液中加入一定量醋酸,得到的酸性混合溶液:c(Na+)>c(CH3COO-)>c(H+)>c(OH-) | |
| D. | 向硝酸钠溶液中滴加稀盐酸得到的pH=5的混合溶液:c(Na+)>c(NO3-) |
17.在下列物质间相互变化中,需要加入氧化剂才能实现的是( )
| A. | H2SO4→MgSO4 | B. | NaCl→Cl2 | C. | CuSO4→Cu | D. | HClO→Cl2 |
14.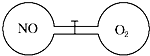 一定温度下,两个体积相等的连通容器用活塞分开,左右两室各充入一定量NO和O2,恰好使两容器内气体密度相同,打开活塞,充分混合反应.下列判断正确的是(不考虑NO2转化为N2O4)( )
一定温度下,两个体积相等的连通容器用活塞分开,左右两室各充入一定量NO和O2,恰好使两容器内气体密度相同,打开活塞,充分混合反应.下列判断正确的是(不考虑NO2转化为N2O4)( )
 一定温度下,两个体积相等的连通容器用活塞分开,左右两室各充入一定量NO和O2,恰好使两容器内气体密度相同,打开活塞,充分混合反应.下列判断正确的是(不考虑NO2转化为N2O4)( )
一定温度下,两个体积相等的连通容器用活塞分开,左右两室各充入一定量NO和O2,恰好使两容器内气体密度相同,打开活塞,充分混合反应.下列判断正确的是(不考虑NO2转化为N2O4)( )| A. | 最终容器内无O2存在 | B. | 反应前、后左室气体压强不变 | ||
| C. | 反应前、后右室气体密度不变 | D. | 开始时左右两室气体分子数相同 |
11.KO2的晶体结构和NaCl相似,KO2可以看作是Na+的位置用K+代替,Cl-的位置用O2-代替,则关于KO2晶体结构的描述正确的是( )
| A. |  如图一个超氧化钾小晶胞中含有4个KO2 | |
| B. | 和K+距离相同且最近的O2-构成的多面体是正六面体 | |
| C. | 和K+距离相同且最近的K+有8个 | |
| D. | 和K+距离相同且最近的O2-共有8个 |
 .
.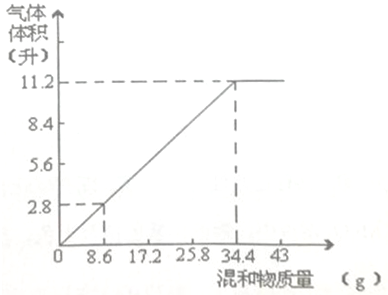 加热碳酸铵[(NH4)2CO3】并使产物全部变成气态.
加热碳酸铵[(NH4)2CO3】并使产物全部变成气态.